Quimiosmose: Diferenzas entre revisións
| Liña 24: | Liña 24: | ||
== A forza protón motriz == |
== A forza protón motriz == |
||
Na maioría dos casos, a [[forza protón motriz]] (FPM) xérase por unha cadea transportadora de electróns, que actúa |
Na maioría dos casos, a [[forza protón motriz]] (FPM) xérase por unha cadea transportadora de electróns, que actúa movendo electróns e bombeando protóns, creando unha separación de carga. Na mitocondria, a liberación de [[enerxía libre de Gibbs|enerxía libre]] desde a cadea transportadora de electróns, é utilizada para mover protóns desde a matriz mitocondrial ao espazo intermembrana da mitocondria. Mover os protones ao compartimento exterior crea alí unha concentración levemente alta de partículas cargadas positivamente (e como son H<sup>+</sup> diminúe alí o [[pH]]), tendo como resultado que un lado da membrana mitocondrial interna é máis positivo e o outro máis negativo (o gradiente eléctrico xerado é de aproximadamente -200 mV coa matriz negativa). |
||
Esta diferenza de carga ten como resultado un [[gradiente electroquímico]]. Este gradiente componse dun gradiente de pH e un gradiente eléctrico. O gradiente de pH corresponde á diferenza na concentración do ión H<sup>+</sup>. Xuntos, o gradiente electroquímico de protóns corresponde á concentración como á diferencia de carga que se poida xerar, e denomínase forza protón motriz (FPM). |
Esta diferenza de carga ten como resultado un [[gradiente electroquímico]]. Este gradiente componse dun gradiente de pH e un gradiente eléctrico. O gradiente de pH corresponde á diferenza na concentración do ión H<sup>+</sup>. Xuntos, o gradiente electroquímico de protóns corresponde á concentración como á diferencia de carga que se poida xerar, e denomínase forza protón motriz (FPM). |
||
Revisión como estaba o 19 de xullo de 2014 ás 20:08
Este artigo está a ser traducido ao galego por un usuario desta Wikipedia; por favor, non o edite. O usuario Miguelferig (conversa · contribucións) realizou a última edición na páxina hai 9 anos. Se o usuario non publica a tradución nun prazo de trinta días, procederase ó seu borrado rápido. |
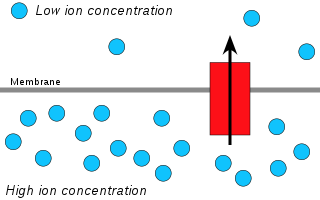
A quimiosmose é a difusión de ións a través dunha membrana, que se relaciona especificamente coa xeración de ATP mediante o movemento de ións hidróxeno (protóns ou H+) a través da membrana interna mitocondrial, da membrana dos tilacoides dos cloroplastos ou membranas bacterianas.
Os protóns difunden desde unha zona de alta concentración a outra de baixa concentración. Peter Mitchell propuxo que un gradiente de concentración electroquímico de protóns a través da membrana podía ser usado para crear ATP. Mitchel viu un paralelismo co proceso de osmose (difusión de auga a través dunha membrana) e por isto foi denominado "quimiosmose".
A ATP sintase é o encima que produce ATP por quimiosmose. Permite o paso de protóns ao seu través, utilizando esa enerxía cinética para fosforilar ADP e así crear ATP.
A teoría quimiosmótica
Peter Mitchell propuxo a "hipótese quimiosmótica" en 1961.[1] Esta teoría propón esencialmente que a maior parte da síntese de ATP na respiración celular, procede dun gradiente electroquímico existente entre a membrana interna e o espazo intermembrana da mitocondria, mediante o uso da enerxía do NADH e FADH2 que se formaron pola rotura de moléculas ricas en enerxía, como a glicosa.

As moléculas como a glicosa, son metabolizadas para producir acetil-CoA como intermediario rico en enerxía. A oxidación de acetil-CoA na matriz mitocondrial está acoplada á redución dunha molécula transportadora como o NAD+ e FAD.[2]
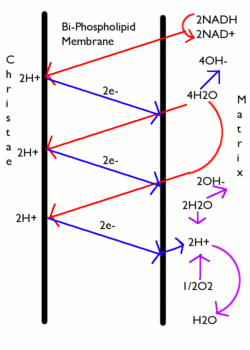
Os transportadores traspasan electróns á cadea de transporte de electróns da membrana mitocondrial interna, que logo os traspasan a outras proteínas da cadea. A enerxía dispoñible dos electróns úsase para bombear protóns desde a matriz, a través da membrana mitocondrial interna, cara ao espazo intermembrana, gardando enerxía en forma dun gradiente electroquímico transmembrana. Os protónss regresan á matriz atravesando de novo a membrana interna, a través do encima ATP sintase. O fluxo de protóns de volta á matriz mitocondrial a través da ATP sintase, proporciona suficiente enerxía para que o ADP se combine con fosfato inorgánico para formar ATP. Os electróns que chegan ao final da cadea de transportadores chegan ao aceptor final de electróns da respiración, que é o oxíxeno molecular (O2), ao cal toma eses electróns e protóns da matriz e orixina auga.
No seu momento esta foi unha proposta radical e non foi ben aceptada. A visión que prevalecía naquel momento era que a enerxía da transferencia electrónica se almacenaba nun intermediario estable de alta enerxía, un concepto máis conservador desde o punto de vista químico. O problema deste vello paradigma era que nunca se encontrou aquel intermediario, e a evidencia do bombeo de protóns polos complexos da cadea de transporte de electróns creceu de forma tal, que non puido ser ignorada. Finalmente, o peso da evidencia comenzou a favorecer a hipótese quimiosmótica, e en 1978, o Premio Nobel de Química concedéuselle a Peter Mitchell.[3]
O acoplamento quimiosmótico é importante na produción de ATP no cloroplasto[4] e moitos tipos de bacterias.[5]
A forza protón motriz
Na maioría dos casos, a forza protón motriz (FPM) xérase por unha cadea transportadora de electróns, que actúa movendo electróns e bombeando protóns, creando unha separación de carga. Na mitocondria, a liberación de enerxía libre desde a cadea transportadora de electróns, é utilizada para mover protóns desde a matriz mitocondrial ao espazo intermembrana da mitocondria. Mover os protones ao compartimento exterior crea alí unha concentración levemente alta de partículas cargadas positivamente (e como son H+ diminúe alí o pH), tendo como resultado que un lado da membrana mitocondrial interna é máis positivo e o outro máis negativo (o gradiente eléctrico xerado é de aproximadamente -200 mV coa matriz negativa).
Esta diferenza de carga ten como resultado un gradiente electroquímico. Este gradiente componse dun gradiente de pH e un gradiente eléctrico. O gradiente de pH corresponde á diferenza na concentración do ión H+. Xuntos, o gradiente electroquímico de protóns corresponde á concentración como á diferencia de carga que se poida xerar, e denomínase forza protón motriz (FPM).
Na mitocondria, a FPM créase maioritariamente polo compoñente eléctrico, mentres que nos cloroplastos, a FPM é creada maiormente polo gradiente de pH, xa que a carga dos protóns é neutralizada polo movemento de Clasup>- e outros anións. En cualquera dos casos, a FPM necesita ser de aproximadamente 50 kJ/mol para que a ATP sintase quede capacitada para producir ATP.
Ecuacións
The proton-motive force is derived from the Gibbs free energy: [6]
ΔG is the Gibbs free energy change during transfer of 1 mol of cations Xm+ from the phase A to B down the electrical potential, Δψ is the electrical potential difference (mV) between phases P and N (A and B), [Xm+]A and [Xm+]B are our cation concentrations on opposite sides of the membrane, F is the Faraday constant, R gas constant. The Gibbs free energy change here is expressed frequently also as electrochemical ion gradient Δμm+
In case of the electrochemical proton gradient the equation can be simplified to:
where
(pH in phase P - pH in phase N)
Mitchell defined the proton-motive force (PMF) as
ΔμH+ = 1 kJ·mol corresponds to Δp = 10.4 mV. At 25 °C (298K) this equation takes the form:
The energy expressed here as Gibbs free energy, electrochemical proton gradient, or proton-motive force (PMF), is a combination of two gradients across the membrane:
- concentration gradient expressed here as ΔpH
- electrical gradient Δψ
When a system reaches equilibrium, ΔG (Δμm+, Δp) = 0, but it doesn't mean that concentrations are equal on both sides of the membrane. The ions' electrical gradient, in addition to the concentration difference, affects spontaneous movement across the membrane.
Sample values: [6]
| Membrane | Δψ (mV) |
ΔpH | Δp (mV) |
ΔGp (kJ·mol−1) |
H+ / ATP |
|---|---|---|---|---|---|
| mitochondrial, inner (liver) | 170 | ≤0.5 | ≤200 | 66 | ≥3.4 |
| chloroplast, thylakoid | 0 | 3.3 | 195 | 60 | 3.1 |
| E. coli cells, pH 7.5 | 140 | ≤0.5 | ≤170 | 40 | ≠ |
ΔGp is the Gibbs free energy of ATP synthesis,
ADP + Pi → ATP
also called phosphorylation potential. The H+ / ATP ratio values in the table above can be calculated by comparison of Δp and ΔGp, for example:
H+ / ATP = 66 kJ·mol−1 / (200 mV / 10.4 kJ·mol−1/mV) = 66 / 19.2 = 3.4 (mitochondrion)
For mitochondria, ΔGp takes here into account 1 H+ consumed to transfer a phosphate molecule (Pi) across the inner membrane into the matrix by the phosphate carrier (PiC). Otherwise it would be lower. In E. coli the H+ / ATP ratio is difficult to determine (marked as ≠).
The energy of more than 3 H+ is required to generate the chemical energy to convert a single ATP. This value is slightly lower than the theoretical number of 4 H+ involved in oxidative phosphorylation of one ADP molecule to ATP during cellular respiration (3 H+ flowing through the ATP synthase / 1 ATP + 1 leaking from the cytoplasm through the phosphate carrier PiC). [6][7]
Diferentes Mecanismos de quimiosmose

Quimiosmose en mitocondrias
- Artigo principal: Fosforilación oxidativa.
A rotura completa dunha molécula de glicosa en presenza de oxíxeno é denominada respiración celular. As últimas etapas deste proceso ocorren na mitocondria. As moléculas de alta enerxía NADH e FADH2, xeradas polo ciclo de Krebs, liberan os electróns cara a unha cadea transportadora de electróns. A enerxía do fluxo de electróns utilízase para bombear protóns desde distintos compoñentes da cadea para crear una gradiente de protóns a través da membrana interna mitocondrial. A ATP sintase é logo usada para xerar ATP por quimiosmose, xa que funciona como un poro permeable aos protóns cando estes se concentran o suficiente. O encima está activo cando os protóns a atravesan e empeza a sintetizar ATP. Este proceso coñécese como fosforilación oxidativa.
A fosforilación quimiosmótica é a principal forma de xerar ATP na célula. Tamén se xera ATP en pequenas cantidades por fosforilación a nivel de substrato na cal non intervén a quimiosmose.
Quimiosmose en plantas
- Artigo principal: Fotofosforilación.
Ademais da quimiosmose mitocondrial, nas plantas as reaccións da fase luminosa da fotosíntese, xeran enerxía mediante quimiosmose. Nos tilacoides, a clorofila perde electróns ao ser excitada ou enerxizada pola luz. O electrón é transportado por unha cadea de transportadores de electróns á vez que estes bombear protóns cara ao interior do tilacoide, on de se acumulan (xunto cos procedentes da rotura da auga na fotólise da auga da fotosíntese). Os electróns recólleos o NADP+ (que forma NADPH). A auga cédelle á clorofila os electróns que perdeu ao darlle a luz, e neste proceso a molécula de auga rompe xerando oxíxeno (que se desprende) e protóns (que contribúen ao gradiente do tilacoide). A acumulación de protóns dentro do tilacoide xera un potencial de membrana; estes protóns saen a través da ATP sintase da membrana tilacoidal, que se activa xerando ATP. Este proceso coñécese como fotofosforilación.
Quimiosmose en bacterias

As bacterias tamén poden utilizar a quimiosmose para xerar ATP. Teñen cadeas de transporte de electróns e ATP sintases nas súas membranas plasmáticas, que bombean protóns cara ao exterio e sintetizan ATP, respectivamente, por un mecanismo quimiosmótico similar ao mitocondrial. Ademais, bacterias fotosintéticas como as cianobacterias e outras crean ATP por un mecanismo similar ao da fotofosforilación dos cloroplastos. De feito, crese que as mitocondrias e os cloroplastos se formaron por endosimbiose de bacterias que podían respirar ou fotosintetizar utilizando a quimiosmose (ver eucarioxénese).
Nas halobacterias hai un acoplamento quimiosmótico especial entre a bacteriorrodopsina, que capta luz e bombea protóns fóra da célula, e a produción de ATP.
Notas
- ↑ Peter Mitchell (1961). "Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism". Nature: 144–148. Parámetro descoñecido
|volumen=ignorado (suxírese|volume=) (Axuda) - ↑ Alberts; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter (2002). "Proton Gradients Produce Most of the Cell's ATP". En Garland. Molecular Biology of the Cell (4ta ed.). ISBN 0-8153-4072-9. Parámetro descoñecido
|nombre=ignorado (suxírese|nome=) (Axuda); A referencia usa o parámetro obsoleto|coautores=(Axuda) - ↑ O Premio Nobel de Química en 1978.
- ↑ Cooper. "Figura 10.22: Electron transport and ATP synthesis during photosynthesis". En Sinauer Associates, Inc. The Cell: A Molecular Approach (2nd ed.). ISBN 0-87893-119-8. Parámetro descoñecido
|nombre=ignorado (suxírese|nome=) (Axuda) - ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter (2002). "Figura 14-32: The importance of H+-driven transport in bacteria". En Garland. Molecular Biology of the Cell. ISBN 0-8153-4072-9. A referencia usa o parámetro obsoleto
|coautores=(Axuda) - ↑ 6,0 6,1 6,2 6,3 Nicholls D. G., Ferguson S, J. (1992). Academic Press, ed. Bioenergetics 2 (2nd ed.). San Diego. ISBN 9780125181242.
- ↑ Erro no código da cita: Etiqueta
<ref>non válida; non se forneceu texto para as referencias de nomeStryer95

![{\displaystyle \Delta G(kJ\cdot mol^{-1})=-mF\Delta \psi +2.3RT\log _{10}\left({[X^{m+}]_{B} \over [X^{m+}]_{A}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01f7cdaab1b9a51cbd973939b9a44b8148dafbea)




