Quimiosmose: Diferenzas entre revisións
| Liña 16: | Liña 16: | ||
As moléculas como a glicosa, son metabolizadas para producir [[acetil-CoA]] como intermediario rico en enerxía. A oxidación de acetil-CoA na matriz mitocondrial está acoplada á redución dunha molécula transportadora como o [[NAD+|NAD<sup>+</sup>]] e [[FAD]].<ref>{{cita libro | nombre=Bruce | apelidos=Alberts | enlaceautor= | coautores=Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter | ano=2002 | título=Molecular Biology of the Cell | edición=4ta | editor=Garland | localidade= | id=ISBN 0-8153-4072-9 | capítulo=Proton Gradients Produce Most of the Cell's ATP | urlcapítulo = http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Search&db=books&doptcmdl=GenBookHL&term=chemiosmotic+AND+mboc4%5Bbook%5D+AND+373681%5Buid%5D&rid=mboc4.section.2495#2519 }}</ref> |
As moléculas como a glicosa, son metabolizadas para producir [[acetil-CoA]] como intermediario rico en enerxía. A oxidación de acetil-CoA na matriz mitocondrial está acoplada á redución dunha molécula transportadora como o [[NAD+|NAD<sup>+</sup>]] e [[FAD]].<ref>{{cita libro | nombre=Bruce | apelidos=Alberts | enlaceautor= | coautores=Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter | ano=2002 | título=Molecular Biology of the Cell | edición=4ta | editor=Garland | localidade= | id=ISBN 0-8153-4072-9 | capítulo=Proton Gradients Produce Most of the Cell's ATP | urlcapítulo = http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Search&db=books&doptcmdl=GenBookHL&term=chemiosmotic+AND+mboc4%5Bbook%5D+AND+373681%5Buid%5D&rid=mboc4.section.2495#2519 }}</ref> |
||
Os transportadores traspasan [[electrón]]s á [[cadea |
Os transportadores traspasan [[electrón]]s á [[cadea de transporte de electróns]] da membrana mitocondrial interna, que logo os traspasan a outras [[proteína]]s da cadea. A enerxía dispoñible dos electróns úsase para bombear protóns desde a matriz, a través da membrana mitocondrial interna, cara ao espazo intermembrana, gardando enerxía en forma dun gradiente electroquímico transmembrana. Os protónss regresan á matriz atravesando de novo a membrana interna, a través do encima [[ATP sintase]]. O fluxo de protóns de volta á matriz mitocondrial a través da ATP sintase, proporciona suficiente enerxía para que o ADP se combine con [[fosfato]] inorgánico para formar ATP. Os electróns que chegan ao final da cadea de transportadores chegan ao aceptor final de electróns da respiración, que é o [[oxíxeno molecular]] (O<sub>2</sub>), ao cal toma eses electróns e protóns da matriz e orixina auga. |
||
No seu momento esta foi unha proposta radical e non foi ben aceptada. A visión que prevalecía naquel momento era que a enerxía da transferencia electrónica se almacenaba nun intermediario estable de alta enerxía, un concepto máis conservador desde o punto de vista químico. O problema deste vello paradigma era que nunca se encontrou aquel intermediario, e a evidencia do bombeo de protóns polos complexos da cadea de transporte de electróns creceu de forma tal, que non puido ser ignorada. Finalmente, o peso da evidencia comenzou a favorecer a hipótese quimiosmótica, e en 1978, o [[Premio Nobel de Química]] concedéuselle a Peter Mitchell.<ref>O [http://nobelprize.org/chemistry/laureates/1978/index.html Premio Nobel] de Química en 1978.</ref> |
No seu momento esta foi unha proposta radical e non foi ben aceptada. A visión que prevalecía naquel momento era que a enerxía da transferencia electrónica se almacenaba nun intermediario estable de alta enerxía, un concepto máis conservador desde o punto de vista químico. O problema deste vello paradigma era que nunca se encontrou aquel intermediario, e a evidencia do bombeo de protóns polos complexos da cadea de transporte de electróns creceu de forma tal, que non puido ser ignorada. Finalmente, o peso da evidencia comenzou a favorecer a hipótese quimiosmótica, e en 1978, o [[Premio Nobel de Química]] concedéuselle a Peter Mitchell.<ref>O [http://nobelprize.org/chemistry/laureates/1978/index.html Premio Nobel] de Química en 1978.</ref> |
||
Revisión como estaba o 19 de xullo de 2014 ás 19:15
Este artigo está a ser traducido ao galego por un usuario desta Wikipedia; por favor, non o edite. O usuario Miguelferig (conversa · contribucións) realizou a última edición na páxina hai 9 anos. Se o usuario non publica a tradución nun prazo de trinta días, procederase ó seu borrado rápido. |
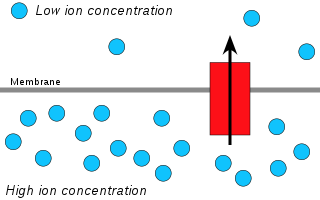
A quimiosmose é a difusión de ións a través dunha membrana, que se relaciona especificamente coa xeración de ATP mediante o movemento de ións hidróxeno (protóns ou H+) a través da membrana interna mitocondrial, da membrana dos tilacoides dos cloroplastos ou membranas bacterianas.
Os protóns difunden desde unha zona de alta concentración a outra de baixa concentración. Peter Mitchell propuxo que un gradiente de concentración electroquímico de protóns a través da membrana podía ser usado para crear ATP. Mitchel viu un paralelismo co proceso de osmose (difusión de auga a través dunha membrana) e por isto foi denominado "quimiosmose".
A ATP sintase é o encima que produce ATP por quimiosmose. Permite o paso de protóns ao seu través, utilizando esa enerxía cinética para fosforilar ADP e así crear ATP.
A teoría quimiosmótica
Peter Mitchell propuxo a "hipótese quimiosmótica" en 1961.[1] Esta teoría propón esencialmente que a maior parte da síntese de ATP na respiración celular, procede dun gradiente electroquímico existente entre a membrana interna e o espazo intermembrana da mitocondria, mediante o uso da enerxía do NADH e FADH2 que se formaron pola rotura de moléculas ricas en enerxía, como a glicosa.

As moléculas como a glicosa, son metabolizadas para producir acetil-CoA como intermediario rico en enerxía. A oxidación de acetil-CoA na matriz mitocondrial está acoplada á redución dunha molécula transportadora como o NAD+ e FAD.[2]
Os transportadores traspasan electróns á cadea de transporte de electróns da membrana mitocondrial interna, que logo os traspasan a outras proteínas da cadea. A enerxía dispoñible dos electróns úsase para bombear protóns desde a matriz, a través da membrana mitocondrial interna, cara ao espazo intermembrana, gardando enerxía en forma dun gradiente electroquímico transmembrana. Os protónss regresan á matriz atravesando de novo a membrana interna, a través do encima ATP sintase. O fluxo de protóns de volta á matriz mitocondrial a través da ATP sintase, proporciona suficiente enerxía para que o ADP se combine con fosfato inorgánico para formar ATP. Os electróns que chegan ao final da cadea de transportadores chegan ao aceptor final de electróns da respiración, que é o oxíxeno molecular (O2), ao cal toma eses electróns e protóns da matriz e orixina auga.
No seu momento esta foi unha proposta radical e non foi ben aceptada. A visión que prevalecía naquel momento era que a enerxía da transferencia electrónica se almacenaba nun intermediario estable de alta enerxía, un concepto máis conservador desde o punto de vista químico. O problema deste vello paradigma era que nunca se encontrou aquel intermediario, e a evidencia do bombeo de protóns polos complexos da cadea de transporte de electróns creceu de forma tal, que non puido ser ignorada. Finalmente, o peso da evidencia comenzou a favorecer a hipótese quimiosmótica, e en 1978, o Premio Nobel de Química concedéuselle a Peter Mitchell.[3]
O acoplamento quimiosmótico é importante na produción de ATP no cloroplasto[4] e moitos tipos de bacterias.[5]
Notas
- ↑ Peter Mitchell (1961). "Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism". Nature: 144–148. Parámetro descoñecido
|volumen=ignorado (suxírese|volume=) (Axuda) - ↑ Alberts; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter (2002). "Proton Gradients Produce Most of the Cell's ATP". En Garland. Molecular Biology of the Cell (4ta ed.). ISBN 0-8153-4072-9. Parámetro descoñecido
|nombre=ignorado (suxírese|nome=) (Axuda); A referencia usa o parámetro obsoleto|coautores=(Axuda) - ↑ O Premio Nobel de Química en 1978.
- ↑ Cooper. "Figura 10.22: Electron transport and ATP synthesis during photosynthesis". En Sinauer Associates, Inc. The Cell: A Molecular Approach (2nd ed.). ISBN 0-87893-119-8. Parámetro descoñecido
|nombre=ignorado (suxírese|nome=) (Axuda) - ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts and Peter Walter (2002). "Figura 14-32: The importance of H+-driven transport in bacteria". En Garland. Molecular Biology of the Cell. ISBN 0-8153-4072-9. A referencia usa o parámetro obsoleto
|coautores=(Axuda)
