Quelato: Diferenzas entre revisións
mSen resumo de edición |
m Bot: Engado: hu:Keláthatás |
||
| Liña 75: | Liña 75: | ||
[[fr:Chélation]] |
[[fr:Chélation]] |
||
[[he:קלאציה]] |
[[he:קלאציה]] |
||
[[hu:Keláthatás]] |
|||
[[io:Kel-ionuro]] |
[[io:Kel-ionuro]] |
||
[[it:Chelazione]] |
[[it:Chelazione]] |
||
Revisión como estaba o 21 de febreiro de 2013 ás 23:03
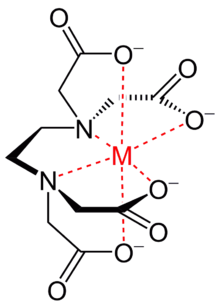
Un quelato é un composto químico formado por un ión metálico ligado por varias ligazóns covalentes a unha estrutura heterocíclica de compostos orgánicos coma aminoácidos, péptidos ou polisacáridos.
O nome quelato provén da palabra grega chele, que significa garra ou pinza, referíndose ao xeito polo cal os ións metálicos son “aprisionados” no composto.
Historia
O termo quelato foi usado por vez primeira en 1920 por Sir Gilbert T. Morgan e H. D. K. Drew, que escribiron : "Propomos o adxectivo quelato, derivado do grego chele (gran garra da lagosta ou outros crustáceos) , para describir os grupos en "brazos de pinza" ("calkiperlike") que funcionan como dúas unidades asociadas entre si e se fixan ao átomo central de modo que producen aneis heterocíclicos."[1]
Quelatos importantes
Algúns quelatos son compostos importantes para a vida na terra, como a hemoglobina e a clorofila.
A clorofila, molécula que sustenta a vida na terra, por ser responsábel da absorción dos fotóns da luz solar nas plantas verdes, é un quelato de Mg (Magnesio).
A hemoglobina, substancia fundamental para a vida, por ser responsábel do transporte de osíxeno (O2) e gas carbónico (CO2) no noso corpo, é un quelato de Fe (ferro).
Na medicina, os quelatos teñen como principais aplicacións o tratamento de envelenamentos e a corrección de deficiencias nutricionais minerais.
No tratamento de envelenamentos metálicos por Pb (chumbo), Hg (mercurio) ou outros elementos, adminístranse axentes quelantes para “secuestrar” os ións metálicos, formando quelatos que posibilitan a súa eliminación polo organismo. Este tipo de tratamento para eliminación de metais tóxicos é ás veces denominado quelación.
No proceso exactamente oposto, adminístranse elementos metálicos quelatados (tamén se poden denominar quelados) para corrixir deficiencias minerais en seres humanos ou animais, por posibilitar a mellor absorción dos ións metálicos no tracto intestinal. Na quimioterapia contra o cancro pódese utilizar Se (selenio) quelatado .
Na agricultura empréganse quelatos para a complexación de metais na produción de fertilizantes foliares e de solo. Moitas veces úsanse ácidos orgánicos ou outros compostos que complexan elementos que doutro xeito a planta non podería absorber polas follas ou polas raíces.
Na química, axentes quelantes poden ser utilizados para remover ións metálicos en solucións.
O EDTA (ácido etileno diamino tetracético =(HO2CCH2)2NCH2CH2N(CH2CO2H)2 ) coordina a través de até 6 puntos doadores preferentemente en xeometría octaédrica. Os sales de EDTA empréganse amplamente na fabricación de deterxentes para complexar o calcio, ou en medicina en casos de intoxicación por metais pesados).
en (1,2- diaminoetano = etilenodiamina = H2NCH2CH2NH2) (coordina a través dos pares libres dos dous átomos de nitróxeno; os compostos octaédricos de fórmula xeral M(en)3n+ son quirais e se poden separar os enantiómeros.
DPPE (1,2-bis(difenilfosfino)etileno = Ph2PCH2CH2) (coordina a través de pares libres de electróns dos dous átomos de fósforo; derivados deste composto empréganse nalgúns catalizadores)
ox (oxalato; sales do ácido oxálico HO2CCO2H)
En síntese orgánica adquiriron un interese especial os ligantes quelatantes quirais xa que se empregan directamente nos catalizadores empregados para obter produtos quirais. (ver p. ex. catalizador de Wilkinson).
Na actualidade existen milleiros de ligantes quelantes tanto sintéticos como naturais coñecidos na bibliografía.
Exemplo: Formación dun complexo cis-platina (II) con etilenodiamina
Véxase tamén
Referencias
- ↑ J. Chem. Soc., 1920, 117, 1456
