Enlace químico: Diferenzas entre revisións
m Bot: Substitución automática de texto (-|thumb| +|miniatura| & -|thumbnail| +|miniatura|) |
mSen resumo de edición |
||
| Liña 1: | Liña 1: | ||
Un '''enlace químico''' (ou '''ligazón química''') é a unión entre dous ou máis [[átomo]]s para formar unha estrutura maior, como unha [[molécula]] ou unha [[estrutura cristalina]], que constituen a estrutura básica dunha [[substancia]] ou [[composto químico]]. Na natureza existen aproximadamente unha centena de [[Elemento químico|elementos químicos]]. Os átomos destes elemento químicos ao unírense forman a grande diversidade de [[Substancia química|substancias químicas]]. |
Un '''enlace químico''' (ou '''ligazón química''') é a unión entre dous ou máis [[átomo]]s para formar unha estrutura maior, como unha [[molécula]] ou unha [[estrutura cristalina]], que constituen a estrutura básica dunha [[Substancia química|substancia]] ou [[composto químico]]. Na natureza existen aproximadamente unha centena de [[Elemento químico|elementos químicos]]. Os átomos destes elemento químicos ao unírense forman a grande diversidade de [[Substancia química|substancias químicas]]. |
||
Mais para que o enlace se produza, débense cumprir unhas condicións axeitadas. Deben ser cumpridas a [[regra do dueto]] e a [[regra do octeto]]. |
Mais para que o enlace se produza, débense cumprir unhas condicións axeitadas. Deben ser cumpridas a [[regra do dueto]] e a [[regra do octeto]]. |
||
Revisión como estaba o 20 de agosto de 2012 ás 12:51
Un enlace químico (ou ligazón química) é a unión entre dous ou máis átomos para formar unha estrutura maior, como unha molécula ou unha estrutura cristalina, que constituen a estrutura básica dunha substancia ou composto químico. Na natureza existen aproximadamente unha centena de elementos químicos. Os átomos destes elemento químicos ao unírense forman a grande diversidade de substancias químicas.
Mais para que o enlace se produza, débense cumprir unhas condicións axeitadas. Deben ser cumpridas a regra do dueto e a regra do octeto.
As ligazóns químicas poden ocorrer a través da doazón e recepción de electróns entre os átomos ou compartillamento de átomos.
Tipos de enlaces
O enlace entre dous átomos nunca se corresponde exactamente cunha das seguintes categorías. Mais, son útiles para clasificar moitas das propiedades de diferentes compostos.
Enlace iónico
- Artigo principal: Enlace iónico.

É a unión que se produce entre dous átomos de electronegatividades distintas, cunha diferenza igual ou maior a 1.67. Neste tipo de enlace ocorre unha transferencia dun ou máis electróns do átomo menos electronegativo para o máis electronegativo. Por iso, o átomo que cedeu electróns fica con carga positiva e o que captou electróns queda con carga negativa.
A ligazón iónica preséntase xeralmente entre os átomos dos grupos:
- I A - VII A
- II A - VI A
- III A - V A
Cando se transfiren electrón dun elemento metálico a un non metálico, existe unha atracción electrovalente entre o catión e o anión, o cal produce un composto de tipo iónico e cuxa estrutura xeralmente é cristalina, como é o caso do sodio e o cloro, que polas súas distribucións electrónicas buscan unha maior estabilidade formando un sal, onde cada ión de cloro está rodeado por seis catións de sodio e cada sodio rodeado por seis anións de cloro.
Enlace covalente
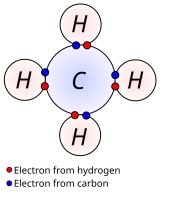
- Artigo principal: Enlace covalente.
As reaccións entre dous átomos non metais producen ligazóns covalentes. Este tipo de enlace prodúcese cando existe unha electronegatividade polar, fórmase cando a diferenza de electronegatividade non é suficientemente grande como para que se efectúe transferencia de electróns, entón os átomos comparten un ou máis pares electrónicos nun novo tipo de orbital, denominado orbital molecular.
Enlace covalente sinxelo
- Artigo principal: Enlace covalente sinxelo.
Cando non existe suficiente diferenza da electronegarividade para que exista transferencia electrónica, resultan dous átomos compartindo un ou máis pares de electróns e forman unha molécula con enerxía de atracción débil e, debido a isto, posúen puntos de fusión e ebulición baixos fronte aos iónicos. Os enlaces poden ser simples, dobres ou triplos, segundo a forma de compartillar un, dous ou tren electróns. Logo podemos debullar disto:
- Ligazón covalente simple: un átomo comparte con outro, dous electróns un con outros (alcanos).
- Ligazón covalente dobre: un átomo comparte con outro, catro electróns, dous de cada átomo (alquenos).
- Ligazón covalente triplo: un átomo comparte con outro, seis electróns, tres de cada átomo (alquino).
A enerxía das forzas de atracción ou repulsión entre os elementos que forman unha ligazón iónica está en función da distancia internuclear chegando a unha distancia mínima onde se compensan as forzas de atracción e de repulsión, a cal se denomina distancia de enlace.
Enlace Van der Waals
As forzas de van der Waals son forzas de estabilización molecular; forman un enlace químico non covalente no que participan dous tipos de forzas ou interaccións, as forzas de dispersión (que son forzas de atracción) e as forzas de repulsión, entre as capas electrónicas de dous átomos contiguos.
Véxase tamén
Outros artigos
| Commons ten máis contidos multimedia sobre: Enlace químico |
