Borrelia burgdorferi
| Borrelia burgdorferi | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Borrelia burgdorferi | |||||||||||||
| Clasificación científica | |||||||||||||
| |||||||||||||
| Nome binomial | |||||||||||||
| Borrelia burgdorferi Johnson et al. 1984 emend. Baranton et al. 1992 | |||||||||||||
Borrelia burgdorferi é unha especie de bacterias do filo das espiroquetas, que ten unha envoltura diderma (de dobre membrana).[1] B. burgdorferi (sensu stricto) é predominante en Norteamérica, pero existe tamén en Europa, e é o axente causante (xunto con outras Borrelia) da enfermidade de Lyme.
A enfermidade de Lyme é unha zoonose, transmitida por un vector, que é a carracha Ixodes. A bacteria recibe o seu nome polo descubridor do axente causante desta doenza Willy Burgdorfer, que foi o primeiro que a illou en 1982.[2] B. burgdorferi é unha das poucas bacterias patoxénicas que pode sobrevivir sen ferro.
O xenoma de B. burgdorferi (cepa B31) foi o terceiro xenoma bacteriano que foi secuenciado, e contén 853 xenes.[3]
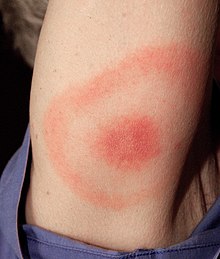
As características clínicas da enfermidade de Lyme poden [4] incluír erupcións cutáneas circulares características (con aspecto de ollos) e eritemas crónicos migrantes, que se espallan perifericamente e non na parte central, e tamén miocardite, cardiomiopatía, arritmia, artrite, artralxia, meninxite, neuropatía e parálise do nervio facial.
As infeccións por B. burgdorferi foron asociadas con linfomas non de Hodgkin.[5]
Xenoma[editar | editar a fonte]
O xenoma de B. burgdorferi (cepa B31) foi o terceiro xenoma microbiano que se secuenciou, despois dos de Haemophilus influenzae e Mycoplasma genitalium en 1995, e contén 910.725 pares de bases e 853 xenes.[3] Comparado co doutras bacterias,o seu xenoma é inusula e moito máis complexo que o doutras espiroquetas como Treponema pallidum, o axente da sífilis.[6] O xenoma de B. burgdorferi B31 consta dun cromosoma linear e 21 plásmidos (12 lineares e 9 circulares), o que é o maior número de plásmidos atopados nunha bacteria[7] O intercambio xenético, no que está incluída a transferencia de plásmidos, contribúe á patoxenicidade do organismo.[8] O cultivo a longo prazo de B. burgdorferi orixina a perda dalgúns plásmidos e cambios no perfil de expresión de proteínas. Asociado coa perda de plásmidos está a perda da capacidade do microorganismo de infectar a animais de laboratorio, o que indica que os plásmidos codifican xenes chave implicados na virulencia.
A análise química da membrana externa de B. burgdorferi atopou que tiña un 46% de proteínas, un 51% de lípidos e un 3% de carbohidratos.[9]
Estrutura e crecemento[editar | editar a fonte]
B. burgdorferi é unha espiroqueta con forma ondulada plana moi especializada, motil (toda a célula móvese con ondulacións parecidas ás dos flaxelos eucariotas), rodeada por dúas membranas, que mide entre 9 e 32 microns de lonxitude.[10] Como ten unha envoltura con dúas membranas, a miúdo descríbese de forma inexacta como bacteria gramnegativa,[11] aínda que se tingue moi debilmente coa tinguidura de Gram. As membranas bacterianas de polo menos as cepas B31, NL303 e N40 de B. burgdorferi non conteñen lipopolisacárido, o cal é moi atípico en bacterias gramnegativas; e no seu lugar as membranas conteñen glicolípidos.[12] Porén, as membranas na cepa B31 conteñen un compoñente similar ao lipolisacárido.[13] B. burgdorferi é un organismo microaerófilo, que require pouco oxíxeno para sobrevivir. A diferenza da maioría das bacterias, B. burgdorferi non utiliza ferro, e deste modo evita a dificultade de obter ferro durante a infección.[14]. Substituíu todos os seus encimas que tiñan clusters de ferro-xofre por encimas que usan manganeso.[15] Vive principalmente como un patóxeno extracelular, aínda que in vitro pode tamén agacharse dentro das células, o que facilita a persistencia das infeccións.
Como outras espiroquetas, B. burgdorferi posúe un filamento axial composto de flaxelos, que discorren lonxitudinalmente entre a súa parede celular e a membrana externa. Esta estrutura permítelle ás espiroquetas moverse eficientemente en medios viscosos como o tecido conxuntivo.
B. burgdorferi crece moi lentamente, cun tempo de duplicación de 12–18 horas[16] (a diferenza de patóxenos como Streptococcus e Staphylococcus, nos que é de 20–30 minutos). Como a maioría dos antibióticos matan as bacterias só cando se están dividindo, isto fai que os tratamentos da enfermidade de Lyme se teñan que prolongar máis tempo do habitual.
Proteínas da membrana externa[editar | editar a fonte]
Borrelia burgdorferi ten un conxunto de proteínas da superficie externa (Osp) singulares, que se denominan con letras desde OspA a OspF. As proteínas Osp son lipoproteínas ancoradas á membrana por moléculas de ácidos graxos unidas ao extremo N-terminal da proteína.[17] Crese que xogan un papel na virulencia, transmisión, ou sobrevivencia na carracha vector.
As proteínas OspA, OspB, e OspD exprésanas as B. burgdorferi que residen no intestino de carrachas non alimentadas, o que suxire que promoven a persistencia da espiroqueta nas carrachas entre comida e comida.[18][19] Durante a transmisión ao hóspede mamífero, cando a carracha ninfa empeza a alimentarse e as espiroquetas do intestino medio empezan a multiplicarse rapidamente, a maioría das espiroquetas deixan de expresar a proteína OspA nas súas superficies. Simultaneamente á desaparición de OspA, a poboación de espiroquetas do intestino medio empeza a expresar OspC e a migrar ás glándulas salivaresdo artrópodo. A regulación á alza de OspC empeza durante o primeiro día de alimentación e chega ao máximo 48 horas despois da adhesión da carracha sobre o hóspede.[20]
Os xenes que codifican as proteínas principais da membrana externa de B. burgdorferi son o ospA e o ospB. As dúas proteínas Osp son moi similares na súa secuencia, o que indica que se orixinaron nun evento de duplicación recente.[21] Virtualmente todas as espiroquetas do intestino medio dunha ninfa de carracha non alimentada expresan OspA. OspA promove a unión de B. burgdorferi á proteína da carracha TROSPA, presente nas células epiteliais do intestino da carracha.[22] OspB ten tamén un papel esencial na adherencia de B. burgdorferi ao intestino da carracha.[23] Aínda que OspD se une a extractos de carracha in vitro (igual que o facían OspA e OspB) non é esencial para a unión e colonización do intestino da carracha, e non é necesaria para a infección nos humanos.[19]
OspC é un forte antíxeno, e a detección da súa presenza polo organismo hóspede estimula unha resposta inmunitaria. Aínda que cada célula da bacteria contén só unha copia do xene ospC, a secuencia do xene ospC é moi variable entre as distintas cepas da especie.[24] OspC xoga un papel esencial durante a fase primaria da infección en mamíferos.[25] Nas carrachas infectadas que se alimentan de hóspedes mamíferos, OspC pode ser tamén necesario para que B. burgdorferi poida invadir e unirse ás glándulas salivares despois de abandonar o intestino, pero non todos os estudos están de acordo con que a proteína teña ese papel.[26][27] OspC únese á proteína salivar da carracha Salp15, o que protexe a espiroqueta do sistema do complemento inmunitario e trastorna o funcionamento das células dendríticas.[28][29][30]
OspE e OspF identificáronse inicialmente na cepa N40 de B. burgdorferi.[31] Os xenes ospE e ospF están dispostos estruturalmente en tándem formando unha unidade transcricional baixo o control dun promotor común.[31] Sábese que cada cepa de B. burgdorferi leva múltiples copias relacionadas do locus ospEF, que agora se denominan en conxunto como erp (OspE/F-like related protein). Nas cepas de B. burgdoreri B31 e 297, a maioría dos loci erp ocupan a mesma posición nas múltiples copias do plásmido cp32 presentes nestas cepas.[32] Cada locus erp consta dun ou dous xenes erp. Cando están presentes dous xenes, transcríbense como un operón, aínda que nalgúns casos, un promotor interno do primeiro xene pode tamén transcribir o segundo xene.[33] Propúxose que a presenza de múltiples proteínas Erp é importante para que B. burgdorferi poida evitar a súa aniquilación pola vía alternativa do complemento nunha ampla variedade de especies hóspedes animais potenciais, xa que cada proteína Erp mostra diferentes patróns de unión ao regulador do complemento factor H de diferentes animais.[34] Porén, demostrouse recentemente que a presenza do factor H non é necesaria para que B. burgdorferi infecte aos ratos, o que suxire que as proteínas Erp deben ter unha función adicional.[35]
Notas[editar | editar a fonte]
- ↑ Samuels DS; Radolf, JD (editors) (2010). "Chapter 6, Structure, Function and Biogenesis of the Borrelia Cell Envelope". Borrelia: Molecular Biology, Host Interaction and Pathogenesis. Caister Academic Press. ISBN 978-1-904455-58-5.
- ↑ Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP (1982). "Lyme disease-a tick-borne spirochetosis?". Science 216 (4552): 1317–9. Bibcode:1982Sci...216.1317B. PMID 7043737. doi:10.1126/science.7043737.
- ↑ 3,0 3,1 Fraser, Claire M.; Casjens, S; Huang, WM; Sutton, GG; Clayton, R; Lathigra, R; White, O; Ketchum, KA; Dodson, R (1997). "Genomic sequence of a Lyme disease spirochaete, Borrelia burgdorferi". Nature 390 (6660): 580–6. PMID 9403685. doi:10.1038/37551.
- ↑ CDC. "Symptoms - Lyme Disease".
- ↑ Guidoboni M, Ferreri AJ, Ponzoni M, Doglioni C, Dolcetti R (2006). "Infectious agents in mucosa-associated lymphoid tissue-type lymphomas: pathogenic role and therapeutic perspectives". Clinical Lymphoma & Myeloma 6 (4): 289–300. PMID 16507206. doi:10.3816/CLM.2006.n.003.
- ↑ Porcella SF, Schwan TG (2001). "Borrelia burgdorferi and Treponema pallidum: a comparison of functional genomics, environmental adaptations, and pathogenic mechanisms". J Clin Invest 107 (6): 651–6. PMC 208952. PMID 11254661. doi:10.1172/JCI12484.
- ↑ Casjens S, Palmer N, van Vugt R, Huang WM, Stevenson B, Rosa P, Lathigra R, Sutton G, Peterson J, Dodson RJ, Haft D, Hickey E, Gwinn M, White O, Fraser CM (2000). "A bacterial genome in flux: the twelve linear and nine circular extrachromosomal DNAs in an infectious isolate of the Lyme disease spirochete Borrelia burgdorferi". Mol Microbiol 35 (3): 490–516. PMID 10672174. doi:10.1046/j.1365-2958.2000.01698.x. Arquivado dende o orixinal o 15 de decembro de 2018. Consultado o 21 de november de 2013.
- ↑ Qiu WG, Schutzer SE, Bruno JF, Attie O, Xu Y, Dunn JJ, Fraser CM, Casjens SR, Luft BJ (2004). "Genetic exchange and plasmid transfers in Borrelia burgdorferi sensu stricto revealed by three-way genome comparisons and multilocus sequence typing" (PDF). Proc Natl Acad Sci USA 101 (39): 14150–5. PMC 521097. PMID 15375210. doi:10.1073/pnas.0402745101.
- ↑ Schwarzová K (1993). "Lyme borreliosis: review of present knowledge". Cesk Epidemiol Mikrobiol Imunol. 42 (2): 87–92. PMID 8348630.
- ↑ Goldstein SF, Charon NW, Kreiling JA (1994). "Borrelia burgdorferi swims with a planar waveform similar to that of eukaryotic flagella". Proc. Natl. Acad. Sci. U.S.A. 91 (8): 3433–7. PMC 43591. PMID 8159765. doi:10.1073/pnas.91.8.3433.
- ↑ Samuels DS; Radolf, JD (editors) (2010). "Ch. 6: Structure, Function and Biogenesis of the Borrelia Cell Envelope". Borrelia: Molecular Biology, Host Interaction and Pathogenesis. Caister Academic Press. ISBN 978-1-904455-58-5.
- ↑ Ben-Menachem G, Kubler-Kielb J, Coxon B, Yergey A, Schneerson R (2003). "A newly discovered cholesteryl galactoside from Borrelia burgdorferi". Proc. Natl. Acad. Sci. U.S.A. 100 (13): 7913–8. PMC 164687. PMID 12799465. doi:10.1073/pnas.1232451100.
- ↑ Schwarzová K, Čižnár I (2004). "Immunochemical analysis of lipopolysaccharide-like component extracted from Borrelia burgdorferi sensu lato" (PDF). Folia Microbiol. 49 (5): 625–9. doi:10.1007/BF02931545. Arquivado dende o orixinal (PDF) o 21 de xullo de 2011. Consultado o 2007-10-26.
- ↑ Posey JE, Gherardini FC (2000). "Lack of a role for iron in the Lyme disease pathogen". Science 288 (5471): 1651–3. PMID 10834845. doi:10.1126/science288.5471.1651.
- ↑ Galdwin, Mark; Trattler, Bill (2009). Spirochetes: Clinical Microbiology Made Ridiculously Simple. MedMaster, Inc. ISBN 978-0-940780-81-1.
- ↑ Kelly, RT (1984). Krieg NR, Holt JG, ed. Genus IV. Borrelia Swellengrebel 1907, 582AL 1. Williams & Wilkins: Baltimore. pp. 57–62.
- ↑ Haake DA (2000). "Spirochaetal lipoproteins and pathogenesis". Microbiology (Reading, Engl.) 146 (7): 1491–1504. PMC 2664406. PMID 10878114.
- ↑ Schwan TG, Piesman J, Golde WT, Dolan MC, Rosa PA (1995). "Induction of an outer surface protein on Borrelia burgdorferi during tick feeding". Proc. Natl. Acad. Sci. U.S.A. 92 (7): 2909–13. PMC 42328. PMID 7708747. doi:10.1073/pnas.92.7.2909.
- ↑ 19,0 19,1 Li X, Neelakanta G, Liu X, Beck DS, Kantor FS, Fish D, Anderson JF, Fikrig E (2007). "Role of outer surface protein D in the Borrelia burgdorferi life cycle". Infect. Immun. 75 (9): 4237–44. PMC 1951184. PMID 17620358. doi:10.1128/IAI.00632-07.
- ↑ Schwan TG, Piesman J (2000). "Temporal changes in outer surface proteins A and C of the Lyme disease-associated spirochete, Borrelia burgdorferi, during the chain of infection in ticks and mice". J Clin Microbiol 38 (1): 382–8. PMC 88728. PMID 10618120.
- ↑ Bergström S, Bundoc VG, Barbour AG (1989). "Molecular analysis of linear plasmid-encoded major surface proteins, OspA and OspB, of the Lyme disease spirochaete Borrelia burgdorferi". Mol. Microbiol. 3 (4): 479–486. PMID 2761388. doi:10.1111/j.1365-2958.1989.tb00194.x.
- ↑ Pal U, Li X, Wang T, Montgomery RR, Ramamoorthi N, Desilva AM, Bao F, Yang X, Pypaert M, Pradhan D, Kantor FS, Telford S, Anderson JF, Fikrig E (2004). "TROSPA, an Ixodes scapularis receptor for Borrelia burgdorferi". Cell 119 (4): 457–468. PMID 15537536. doi:10.1016/j.cell.2004.10.027.
- ↑ Neelakanta G, Li X, Pal U, Liu X, Beck DS, DePonte K, Fish D, Kantor FS, Fikrig E (2007). "Outer surface protein B is critical for Borrelia burgdorferi adherence and survival within Ixodes ticks". PLoS Pathog. 3 (3): e33. PMC 1817655. PMID 17352535. doi:10.1371/journal.ppat.0030033.
- ↑ Baranton G, Seinost G, Theodore G, Postic D, Dykhuizen D (2001). "Distinct levels of genetic diversity of Borrelia burgdorferi are associated with different aspects of pathogenicity". Res. Microbiol. 152 (2): 149–56. PMID 11316368. doi:10.1016/S0923-2508(01)01186-X.
- ↑ Tilly K, Krum JG, Bestor A, Jewett MW, Grimm D, Bueschel D, Byram R, Dorward D, Vanraden MJ, Stewart P, Rosa P (2006). "Borrelia burgdorferi OspC protein required exclusively in a crucial early stage of mammalian infection". Infect. Immun. 74 (6): 3554–64. PMC 1479285. PMID 16714588. doi:10.1128/IAI.01950-05.
- ↑ Pal U, Yang X, Chen M, Bockenstedt LK, Anderson JF, Flavell RA, Norgard MV, Fikrig E (2004). "OspC facilitates Borrelia burgdorferi invasion of Ixodes scapularis salivary glands". J. Clin. Invest. 113 (2): 220–30. PMC 311436. PMID 14722614. doi:10.1172/JCI19894.
- ↑ Grimm D, Tilly K, Byram R, Stewart PE, Krum JG, Bueschel DM, Schwan TG, Policastro PF, Elias AF, Rosa PA (2004). "Outer-surface protein C of the Lyme disease spirochete: a protein induced in ticks for infection of mammals". Proc. Natl. Acad. Sci. U.S.A. 101 (9): 3142–7. PMC 365757. PMID 14970347. doi:10.1073/pnas.0306845101.
- ↑ Ramamoorthi N, Narasimhan S, Pal U, Bao F, Yang XF, Fish D, Anguita J, Norgard MV, Kantor FS, Anderson JF, Koski RA, Fikrig E (2005). "The Lyme disease agent exploits a tick protein to infect the mammalian host". Nature 436 (7050): 573–7. PMID 16049492. doi:10.1038/nature03812.
- ↑ Schuijt TJ, Hovius JW, van Burgel ND, Ramamoorthi N, Fikrig E, van Dam AP (2008). "The tick salivary protein Salp15 inhibits the killing of serum-sensitive Borrelia burgdorferi sensu lato isolates". Infect. Immun. 76 (7): 2888–94. PMC 2446733. PMID 18426890. doi:10.1128/IAI.00232-08.
- ↑ Hovius JW, de Jong MA, den Dunnen J, Litjens M, Fikrig E, van der Poll T, Gringhuis SI, Geijtenbeek TB (2008). "Salp15 binding to DC-SIGN inhibits cytokine expression by impairing both nucleosome remodeling and mRNA stabilization". PLoS Pathog. 4 (2): e31. PMC 2242833. PMID 18282094. doi:10.1371/journal.ppat.0040031.
- ↑ 31,0 31,1 Lam TT, Nguyen TP, Montgomery RR, Kantor FS, Fikrig E, Flavell RA (1994). "Outer surface proteins E and F of Borrelia burgdorferi, the agent of Lyme disease". Infect. Immun. 62 (1): 290–8. PMC 186099. PMID 8262642.
- ↑ Stevenson B, Zückert WR, Akins DR (2000). "Repetition, conservation, and variation: the multiple cp32 plasmids of Borrelia species". J. Mol. Microbiol. Biotechnol. 2 (4): 411–422. PMID 11075913.
- ↑ Stevenson B, Bono JL, Schwan TG, Rosa P (1998). "Borrelia burgdorferi Erp proteins are immunogenic in mammals infected by tick bite, and their synthesis is inducible in cultured bacteria". Infect. Immun. 66 (6): 2648–54. PMC 108251. PMID 9596729.
- ↑ Stevenson B, El-Hage N, Hines MA, Miller JC, Babb K (2002). "Differential binding of host complement inhibitor factor H by Borrelia burgdorferi Erp surface proteins: a possible mechanism underlying the expansive host range of Lyme disease spirochetes". Infect. Immun. 70 (2): 491–7. PMC 127719. PMID 11796574. doi:10.1128/IAI.70.2.491-497.2002.
- ↑ Woodman ME, Cooley AE, Miller JC, Lazarus JJ, Tucker K, Bykowski T, Botto M, Hellwage J, Wooten RM, Stevenson B (2007). "Borrelia burgdorferi binding of host complement regulator factor H is not required for efficient mammalian infection". Infect. Immun. 75 (6): 3131–9. PMC 1932899. PMID 17420242. doi:10.1128/IAI.01923-06.
Véxasde tamén[editar | editar a fonte]
| Wikispecies posúe unha páxina sobre: Borrelia burgdorferi |
