Ácido isovalérico
| Ácido 3-metilbutanoico | |
|---|---|
 | |
 | |
Ácido 3-metilbutanoico | |
Outros nomes Ácido isovalérico | |
| Identificadores | |
| Número CAS | 503-74-2 |
| PubChem | 10430 |
| ChemSpider | 10001 |
| UNII | 1BR7X184L5 |
| DrugBank | DB03750 |
| KEGG | C08262 |
| ChEBI | CHEBI:28484 |
| ChEMBL | CHEMBL568737 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C5H10O2 |
| Masa molecular | 102,13 g/mol |
| Densidade | 0,925 g/cm3 |
| Punto de fusión | −29 °C; −20 °F; 244 K |
| Punto de ebulición | 175–177 °C; 347–351 °F; 448–450 K |
| -67,7·10−6 cm3/mol | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O ácido isovalérico, tamén chamado ácido 3-metilbutanoico ou ácido β-metilbutírico, é un composto orgánico coa fórmula (CH3)2CHCH2CO2H. Ás veces clasifícase como ácido graxo de cadea curta.[1] É un líquido incoloro que é moderadamente soluble en auga, pero moi soluble na maioría dos solventes orgánicos. O ácido 3-metilbutanoico é un composto que se encontra na natureza e pode encontrarse en moitos produtos alimenticios, como o queixo, leite de soia e zume de mazá.
O ácido isovalérico ten un cheiro forte picante a queixo ou doce e os seus ésteres volátiles son amplamente usados en perfumería. Propúxose que é o axente anticonvulsivo da valeriana.[2] É o responsable principal da causa do intenso cheiro a pés que producen as bacterias da pel que metabolizan a leucina.[3]
O ácido isovalérico considérase a causa primaria dos aromas que engaden ao viño os lévedos Brettanomyces.[4] Outros compostos producidos por Brettanomyces son o 4-etilfenol, o 4-vinilfenol e o 4-etilguaiacol.[5] Un exceso de ácido isovalérico no viño adoita considerarse un defecto,[5] xa que pode facer que cheire a suor, a coiro ou como un cortello, pero en pequenas cantidades pode parecer un olor afumado, especiado ou medicinal.[4] Estes fenómenos poden impedirse matando os lévedos Brettanomyces por medio de filtración estéril, ou por adición de cantidades relativamente grandes de dióxido de xofre e ás veces de ácido sórbico, ou mesturándoo con bebidas alcohólicas fortes para orixinar un viño fortificado con suficiente forza como para matar todos os levedos e bacterias, ou por pasteurización. O ácido isovalérico pode atoparse tamén na cervexa, e, excepto nalgunhas cervexas ale de estilo inglés, considérase un defecto.[6] Pode producirse pola oxidación de resinas de lúpulo ou polos lévedos Brettanomyces presentes.[6]
Usos[editar | editar a fonte]
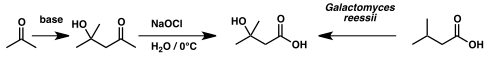
O ácido isovalérico foi utilizado para sintetizar o ácido β-hidroxiisovalérico (tamén chamado ácido β-hidroxi β-metilbutírico) por oxidación microbiana feita polo fungo Galactomyces reessii.[7]
Notas[editar | editar a fonte]
- ↑ Pubchem Isolaveric acid
- ↑ Eadie, Mervyn J. (November 2004). "Could Valerian Have Been the First Anticonvulsant?". Epilepsia 45 (11): 1338–1343. PMID 15509234. doi:10.1111/j.0013-9580.2004.27904.x.
- ↑ Ara, Katsutoshi; Hama, Masakatsu; Akiba, Syunichi; Koike, Kenzo; Okisaka, Koichi; Hagura, Toyoki; Kamiya, Tetsuro; Tomita, Fusao (April 2006). "Foot odor due to microbial metabolism and its control". Canadian Journal of Microbiology 52 (4): 357–364. PMID 16699586. doi:10.1139/w05-130.
- ↑ 4,0 4,1 Jackson, Ron S. (2008). Wine Science: Principles and Applications (3rd ed.). Academic Press. p. 495. ISBN 9780123736468. Consultado o December 22, 2012.
- ↑ 5,0 5,1 Kirk-Othmer (2007). "Wine". Food and Feed Technology, Volume 2. John Wiley & Sons. p. 702. ISBN 9780470174487. Consultado o December 22, 2012.
- ↑ 6,0 6,1 Oliver, Garrett, ed. (2012). The Oxford Companion to Beer. Oxford University Press. p. 498. ISBN 9780195367133. Consultado o December 22, 2012.
- ↑ Lee IY, Nissen SL, Rosazza JP (1997). "Conversion of beta-methylbutyric acid to beta-hydroxy-beta-methylbutyric acid by Galactomyces reessii" (PDF). Applied and Environmental Microbiology 63 (11): 4191–5. PMC 168736. PMID 9361403. doi:10.1128/AEM.63.11.4191-4195.1997. Arquivado dende o orixinal (PDF) o 03 de setembro de 2020. Consultado o 01 de setembro de 2020.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Ácido 2-metilbutanoico
- Acidemai isovalérica
- Ácido valérico, un isómero
