Rato knockout
Un rato knockout é un rato modificado xeneticamente por enxeñaría xenética ao cal os investigadores lle inactivaron (ver knockout de xenes) un dos seus xenes ao interromper dito xene ou substituílo cun fragmento de ADN artificial. A perda da actividade do xene a miúdo causa cambios no fenotipo do rato, que afectan á súa aparencia, comportamento, metabolismo ou calquera outra característica física ou bioquímica observable ou detectable.
Os ratos knockout son importantes modelos animais para a experimentación no estudo da función de xenes que xa foron secuenciados pero dos que se descoñece as súas funcións. Facendo que se inactive deste modo un determinado xene no rato, e observando as diferenzas entre o comportamento ou fisioloxía normais e as que presenta despois do procedemento do knockout, os investigadores poden inferir a súa probable función.
Os ratos son actualmente a especie modelo máis próxima ao ser humano na que pode aplicarse con maior facilidade a técnica do knockout. Son amplamente usados nas investigacións xenéticas sobre a fisioloxía humana. O knockout de xenes nas ratas é moito máis difícil ca en ratos e só leva realizándose desde 2003.[1][2]
O primeiro rato knockout foi creado por Mario R. Capecchi, Martin Evans e Oliver Smithies en 1989, e por eses traballo foron galardoados co Premio Nobel de Medicina en 2007. En moitos países foron patentados diversos aspectos da tecnoloxía para xerar ratos knockout e os propios ratos knockout por compañías privadas.
Usos[editar | editar a fonte]
Anular por knockout a actividade dun xene proporciona información sobre o que o xene normalmente fai na célula. Os seres humanos compartimos moitos xenes cos ratos, polo que a experimentación con eles serve para comprender a función dos xenes humanos e a súa contribución a certas enfermidades. Exemplos de investigacións nas cales foron moi útiles os ratos knockout son o estudo e modelización de diversos tipos de cánceres, obesidade, enfermidades cardíacas, diabetes, artrite, abuso de drogas, ansiedade, envellecemento e enfermidade de Parkinson. Os ratos knockout tamén ofrecen un contexto científico e biolóxico no cal poden ser desenvolvidas e comprobadas fármacos e outras terapias. Cada ano utilízanse en experimentación millóns de ratos knockout.[3]
Liñas de ratos knockout[editar | editar a fonte]

Existen varios miles de liñas de ratos knockout.[3] Moitos modelos de ratos foron nomeados polo nome do xene que teñen inactivado. Por exemplo, o rato knockout p53 recibe ese nome polo xene P53, que codifica unha proteína que suprime normalmente o crecemento de tumores ao deter a división celular. Os seres humanos que nacen con mutacións que desactivan o xene p53 sofren a síndrome de Li-Fraumeni, unha condición que incrementa sensiblemente o risco de desenvolver cáncer de óso, de mama ou de sangue a idades novas. Outros modelos de ratos denomínanse, a miúdo moi imaxinativamente, de acordo coas súas características físicas ou comportamentos.
Procedemento[editar | editar a fonte]
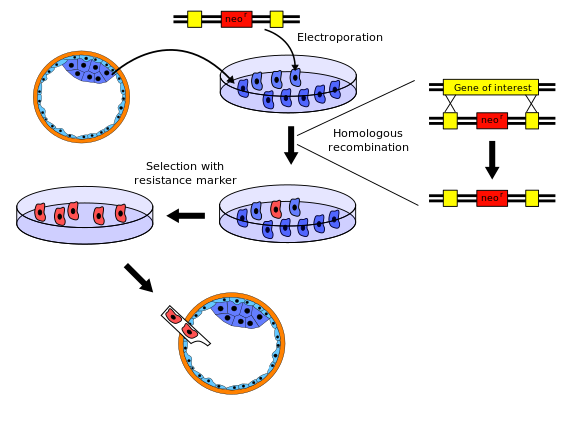

No procedemento para obter ratos knockout hai varias variantes. O seguinte é un exemplo típico:
- O xene que se quere anular mediante o knockout íllase dunha libraría de xenes de rato. Despois, créase por enxeñaría xenética unha nova secuencia de ADN moi similar á do xene orixinal que se quere anular e á súa secuencia veciña, pero á que se lle fan os suficientes cambios para facer ese xene inoperativo. Normalmente, á nova secuencia se lle engade un xene marcador, un xene que os ratos normais non teñen e que lle confire resistencia a algún determinado axente tóxico ou que produce un cambio observable (por exemplo, cor ou fluorescencia).
- Íllanse células nai dun blastocisto de rato (embrión nunha das súas fases iniciais) e cultívanse in vitro. Para explicar o exemplo, supoñamos que se toma unha célula nai dun rato branco.
- A nova secuencia de ADN creada no punto 1 introdúcese agora nas células nai do punto 2 por electroporación (pequenas descargas eléctricas que favorecen a permeabilidade das membranas). O proceso natural da recombinación xenética de homólogos consiste neste caso en que algunhas das células nai electroporadas incorporan aos seus cromosomas a nova secuencia de ADN co xene anulado (knocked-out) en lugar do xene orixinal. As probabilidades de éxito nesta recombinación son relativamente baixas, polo que a maioría das células alteradas terán a nova secuencia en só un dos dous cromosomas homólogos onde está o xene en cuestión, polo que estará en heterocigose.
- As células nai que incorporaron o xene "noqueado" (knocked-out) son separadas das células que quedaron inalteradas utilizando o xene marcador do paso 1. Por exemplo, poden matarse as células inalteradas utilizando un axente tóxico ao cal as células alteradas son resistentes porque o xene marcador lles dá resistencia a el.
- As células nai que si sufriron o knockout do punto 4 insírense nun blastocisto de rato. No noso exemplo utilizaremos blastocistos de rato gris. Os blastocistos conteñen agora dous tipos de células nai: as orixinais do rato gris, e as células co xene anulado por knockout do rato branco. Estes blastocistos implántanse no útero dunha femia de rato, onde se desenvolverán ata o nacemento. Os ratos acabados de nacer serán, por tanto, quimeras, xa que parte das súas células teñen unha procedencia (as células nai orixinais) e outras outra (as células nai "noqueadas" ou knocked-out). A pel dos ratiños terá manchas brancas e grises, as brancas derivadas das células nai "noqueadas" e as grises das células nai orixinais do blastocisto receptor.
- Algunhas das quimeras recentemente nadas terán gónadas derivadas de células nai "noqueadas" (knocked-out), e producirán óvulos e espermatozoides que conteñen o xene knocked-out. Cando estes ratos quimera sexan cruzados con outros do tipo salvaxe, algúns dos seus descendentes levarán unha copia do xene "noqueado" (knocked-out) en todas as súas células. Estes ratos serán totalmente brancos e non son quimeras, aínda que son heterocigotos.
- Cando esta descendencia heterocigota é cruzada entre si, parte dos seus descencdentes herdará o gene "noqueado" (knocked-out) de ambos os seus proxenitores, polo que será homocigoto para ese alelo e xa non levará ningunha copia do xene orixinal.
Unha explicación detallada de como se crean os ratos knockout pode atoparse na páxina do Premio Nobel de Fisioloxía e Medicina de 2007.[4]
Limitacións[editar | editar a fonte]
A técnica de creación de ratos knockout ten algunhas limitacións. A seguinte cita procede dos National Institutes of Health (Institutos Nacionais da Saúde) dos EEUU e nela discútense varias importantes limitacións desta técnica:[5]
Aínda que a tecnoloxía dos ratos knockout supón unha valiosa ferramenta da investigación, ten algunhas importantes limitacións. Arredor do 15 % dos knockouts de xenes son letais no desenvolvemento embrionario, o que significa que os embrións alterados xeneticamente non poden crecer orixinando un adulto. Este problema pode xeralmente superarse co uso de mutacións condicionais. A falta do rato adulto limita os estudos de desenvolvemento embrionario e normalmente fai máis difícil determinar a función do xene en relación coa saúde humana. Nalgúns casos o xene pode realizar unha función diferente en adultos ca nos embrións en desenvolvemento.
O knockout dun xene pode tamén fallar en producir un cambio observable nun rato ou pode mesmo producir características diferentes das observadas nos seres humanos nos cales se desactiva o mesmo xene. Por exemplo, as mutacións no xene p53 están asociadas con máis da metade dos cánceres humanos e a miúdo orixinan tumores nuns determinados tecidos. Porén, cando o xene p53 está anulado (knocked out) nos ratos, os animais desenvolven os tumores nun conxunto de tecidos diferente.
Hai variabilidade en todo o procedemento dependendo principalmente da liña a partir da cal se derivaron as células nai ou troncais. En xeral, úsanse as células derivadas da liña 129. Esta liña específica non é axeitada para moitos experimentos (por exemplo, os estudos de comportamento), polo que é moi común facer retrocruzamentos da proxenie con outras liñas. A algúns loci xenómicos é moi difícil aplicarlles o knockout. As razóns disto poden ser a presenza de secuencias repetitivas, extensa metilación do ADN, ou de heterocromatina. Denomínase "efecto dos xenes flanqueantes" a confusión causada pola presenza de xenes veciños do 129 no segmento knockout de material xenético.[6] Propuxéronse métodos e directrices para enfrontarse a este problema.[7][8]
Outra limitación é que os ratos knockout convencionais (é dicir, non condicionais) desenvólvense en ausencia do xene investigado. Ás veces, a perda de actividade do xene durante o desenvolvemento embrionario pode enmascarar o papel do xene no estado adulto. Requírense entón enfoques experimentais usando mutacións condicionais/inducibles que permitan primeiro que se desenvolva o rato e madure normalmente antes de anular o xene que interesa estudar.
Outra seria limitación é a ausencia de adaptacións evolutivas no modelo knockout que poderían aparecer nos animais de tipo salvaxe por mutacións naturais. Por exemplo, a coexpresión específica dos eritrocitos do GLUT1 coa estomatina constitúe un mecanismo compensatorio en mamíferos que non poden sintetizar vitamina C.[9]
Notas[editar | editar a fonte]
- ↑ naturenews, 19 May 2003
- ↑ "Y Zan et al., Production of knockout rats using ENU mutagenesis and a yeast-based screening assay, Nat. Biotechnol. (2003)." (PDF). Arquivado dende o orixinal (PDF) o 11 de xuño de 2010. Consultado o 06 de marzo de 2012.
- ↑ 3,0 3,1 genome.gov | Background on Mouse as a Model Organism
- ↑ Nobel Prize in Physiology or Medicine 2007
- ↑ http://www.genome.gov/12514551
- ↑ Gerlai R (1996). "Gene-targeting studies of mammalian behavior: is it the mutation or the background genotype?". Trends in Neurosciences 19 (5): 177–81. PMID 8723200. doi:10.1016/S0166-2236(96)20020-7. Consultado o 2010-03-07.
- ↑ Wolfer DP, Crusio WE, Lipp HP (2002). "Knockout mice: simple solutions to the problems of genetic background and flanking genes". Trends in Neurosciences 25 (7): 336–40. PMID 12079755. doi:10.1016/S0166-2236(02)02192-6. Consultado o 2010-03-07.
- ↑ Crusio WE, Goldowitz D, Holmes A, Wolfer D (2009). "Standards for the publication of mouse mutant studies". Genes, Brain, and Behavior 8 (1): 1–4. PMID 18778401. doi:10.1111/j.1601-183X.2008.00438.x. Consultado o 2010-03-07.
- ↑ Montel-Hagen, Amélie; Kinet, Sandrina; Manel, Nicolas; Mongellaz, Cédric; Prohaska, Rainer; Battini, Jean-Luc; Delaunay, Jean; Sitbon, Marc; Taylor, Naomi (21). "Erythrocyte Glut1 triggers dehydroascorbic acid uptake in mammals unable to synthesize vitamin C". Cell 132 (6): 1039–1048. PMID 18358815. doi:10.1016/j.cell.2008.01.042.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Organismo modificado xeneticamente
- Knockout de xenes
- Knockdown de xenes
- Gene targeting
- Musgo knockout
Ligazóns externas[editar | editar a fonte]
- Texas A&M Institute for Genomic Medicine (TIGM) - The web site for ordering ES cells and mice generated by TIGM
- Studying Gene Function: Creating Knockout Mice - a review from the Science Creative Quarterly
- The Knock Out Mouse Project (KOMP) Data Coordination website - The public interface for information on the status of the genes included in the KOMP initiative.
- The Knock Out Mouse Project (KOMP) Repository website Arquivado 09 de outubro de 2020 en Wayback Machine.- The web site for ordering ES cells, vectors, and mice generated by the KOMP project
- Mouse Genome Informatics (MGI) website - community model organism database for the laboratory mouse
- Homologous Recombination Method (and Knockout Mouse)
