Perforina
| |
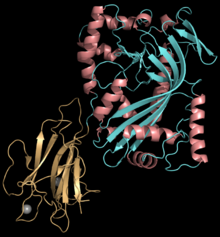
| Estrutura dunha proteína Plu-MACPF que contén o dominio MACPF: PDB 2QP2 [1] O dominio MACPF está representado en ciano/rosa. Outro dominio está en laranxa e dous átomos de calcio en gris. | |
Perforina 1 (proteína formadora de poros)
| |
| Identificadores | |
| Símbolo | PRF1 |
| Símbolos alt. | FLH2; HPLH2; P1; PFN1; PFP |
| Entrez | 5551 |
| OMIM | |
| RefSeq | NP_001076585 |
| UniProt | P14222 |
| Outros datos | |
| Locus | Cr. 10 (72.36 – 72.36 Mb) |
A perforina (PRF 1), é unha proteína monomérica e oligomérica,[2] mediadora da función da lise celular.[3] Esta molécula prodúcena as células NK e os linfocitos T, e está codificada no xene PRF1 do cromosoma 10 humano [4][5] (locus q22.1). Posúe certas similitudes coas proteínas que forman o CAM (Complexo de Ataque á Membrana) e pertence, xunto ás serina proteases pre-apoptóticas e as granzimas, ao grupo de moléculas encargadas da inmunorregulación do sistema inmunitario.
Función[editar | editar a fonte]
A perforina almacénase en vesículas especiais das células NK e linfocitos T.[6] Unha vez que se produce a desgranulación, a perforina acóplase á membrana plasmática da célula diana na que orixina a formación de poros de 20 nm dependente do calcio,[7] que desestabilizan osmoticamente a célula e cáusanlle a morte por lise osmótica. Porén, para que se produza esta lise osmótica de maneira funcional fai falta que se lle acople outra molécula, a granzima B. A parte lítica inserida na membrana da perforina é o dominio MACPF.[8] Esta rexión comparte homoloxía coa citolisina dependente de colesterol das bacterias grampositivas.[1]
Ademais, tamén cumpre unha función de inmunitaria, xa que pode atacar e eliminar especificamente células tumorais[9] e células infectadas por virus,[3] polo que exerce unha función de homeostase inmune. Tamén ten a función de protexer ao organismo da sepse intracelular, e, por último, ten un papel moi importante na apoptose.[10][11][12][13]
A perforina ten semellanzas estruturais e funcionais co compoñente do complemento 9 (C9). Igual que C9, esta proteína crea túbulos transmembrana e pode lisar de modo non específico diversas células diana. Esta proteína é unha das principais proteínas citolíticas presente nos gránulos citolíticos, e é unha mediadora fundamental nos efectos citolíticos das células T e NK.[14] Crese que a perforina actúa xerando perforacións na membrana plasmática que orixinan un influxo de calcio e inician os mecanismos de reparación das membranas. Estes mecanismos de reparación levan a perforina e as granzimas aos endosomas temperáns.[15]
Doenzas asociadas[editar | editar a fonte]
As doenzas asociadas á perforina divídense basicamente en dous grandes grupos: por unha parte están as doenzas asociadas a unha falta completa de liberación de perforina, e por outra aquelas nas que hai unha liberación disfuncional da PRF 1, este último grupo é o causante de múltiples doenzas, entre as cales se atopan as seguintes:
- Síndrome de Inmunoinsuficiencia: É debido a defectos cromosómicos conxénitos ou adquiridos que causan que as células T e NK non poidan producir a suficiente perforina. Unha liberación deficiente de perforina causa infeccións recorrentes.
- Linfohistiocitose hemofagocítica de tipo2 (HPLH2): Doenza xenética, autosómica recesiva causada pola substitución de dous dos aminoácidos situados no dominio C2: T435M. Anteriormente, críase que o causante era o dominio Y438C. Cursa con disfunción da desgranulación, febre, hepatoesplenomegalia, citopenia e hipertrigliceridemia, hipofibroxenemia e anormalidades neurolóxicas, entre outros signos e síntomas. O seu tratamento de elección baséase no transplante de medula ósea, normalmente na infancia.[7]
- Deficiencia de PRF 1: trastorno agresivo da inmunorregulación debido a unha perda completa das funcións dos linfocitos T citotóxicos, que se pensa que é un factor importante para padecer algún cancro hematolóxico maligno.[16]
- Esclerose múltiple: nun estudo feito na poboación española sobre o polimorfismo dun único nucleótido do xene da perforina, que causa un aumento da susceptibilidade a padecer esclerose múltiple.[17]
Interaccións[editar | editar a fonte]
A perforina interacciona coa calreticulina.[18]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Rosado CJ, Buckle AM, Law RH, Butcher RE, Kan WT, Bird CH, Ung K, Browne KA, Baran K, Bashtannyk-Puhalovich TA, Faux NG, Wong W, Porter CJ, Pike RN, Ellisdon AM, Pearce MC, Bottomley SP, Emsley J, Smith AI, Rossjohn J, Hartland EL, Voskoboinik I, Trapani JA, Bird PI, Dunstone MA, Whisstock JC (2007). "A common fold mediates vertebrate defense and bacterial attack". Science 317 (5844): 1548–51. doi:10.1126/science.1144706. PMID 17717151.
- ↑ Unitprot. "P14222 (PERF_HUMAN)". Consultado o 8 de decembro de 2010.
- ↑ 3,0 3,1 Voskoboinik I, Dunstone MA, Baran K, Whisstock JC, Trapani JA (2010). "Perforin: structure, function and role in human immunopathology". Immunol Rev. 235 (1): 35–54. PMID 20536554.
- ↑ Fink TM, Zimmer M, Weitz S, Tschopp J, Jenne DE, Lichter P (Sep 1992). "Human perforin (PRF1) maps to 10q22, a region that is syntenic with mouse chromosome 10". Genomics 13 (4): 1300–2. doi:10.1016/0888-7543(92)90050-3. PMID 1505959.
- ↑ Shinkai Y, Yoshida MC, Maeda K, Kobata T, Maruyama K, Yodoi J, Yagita H, Okumura K (Jan 1990). "Molecular cloning and chromosomal assignment of a human perforin (PFP) gene". Immunogenetics 30 (6): 452–7. doi:10.1007/BF02421177. PMID 2592021.
- ↑ Bi E, Huang C, Hu Y, Wu X, Deng W, Lin G, Liu Z, Tian L, Sun S, Mao K, Zou J, Zheng Y, Sun B (2009). "Novel function of perforin in negatively regulating CD4(+) T cell activation by affecting calcium signaling". Cell Res 19 (7): 816–27. PMID 19290021.
- ↑ 7,0 7,1 Urrea Moreno R, Gil J, Rodriguez-Sainz C, Cela E, LaFay V, Oloizia B, Herr AB, Sumegi J, Jordan MB, Risma KA (2008). "Functional assessment of perforin C2 domain mutations illustrates the critical role for calcium-dependent lipid binding in perforin cytotoxic function". Blood 113 (2): 338–46. PMID 18927437.
- ↑ Tschopp J, Masson D, Stanley KK (1986). "Structural/functional similarity between proteins involved in complement- and cytotoxic T-lymphocyte-mediated cytolysis". Nature 322 (6082): 831–4. PMID 2427956. doi:10.1038/322831a0.
- ↑ Trapani JA, Voskoboinik I (2007). "Infective, neoplastic, and homeostatic sequelae of the loss of perforin function in humans". Adv Exp Med Biol 601: 235–42. PMID 17713010.
- ↑ Zhou F (2010). "Perforin: more than just a pore-forming protein". Int Rev Immunol 29 (1): 56–76. PMID 20100082.
- ↑ Shleptsova VA, Trushkin EV, Bystryh OA, Davydov JI, Obrazcova NP, Grebenuk ES, Tonevitsky AG (2010). "Expression of Early Immune Response Genes during Physical Exercise". Bull Exp Biol Med 149 (1): 89–92. PMID 21113467.
- ↑ Djeu JY, Jiang K, Wei S (2002). "A view to a kill: signals triggering cytotoxicity". Clin Cancer Res 8 (3): 636–40. PMID 11895890.
- ↑ Voskoboinik I, Sutton VR, Ciccone A, House CM, Chia J, Darcy PK, Yagita H, Trapani JA (2007). "Perforin activity and immune homeostasis: the common A91V polymorphism in perforin results in both presynaptic and postsynaptic defects in function". Blood 110 (4): 1184–90. PMID 17475905.
- ↑ Entrez Gene: PRF1 perforin 1 (pore forming protein)".
- ↑ Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, Goping IS, Bleackley RC, Kirchhausen T, Lieberman J (2011). "Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells". Nat. Immunol. 12 (8): 770–7. PMC 3140544. PMID 21685908. doi:10.1038/ni.2050.
- ↑ Brennan AJ, Chia J, Trapani JA, Voskoboinik I (2010). "Perforin deficiency and susceptibility to cancer". Cell Death Differ 17 (4): 607–15. PMID 20075937.
- ↑ Camiña-Tato M, Morcillo-Suárez C, Bustamante MF, Ortega I, Navarro A, Muntasell A, López-Botet M, Sánchez A, Carmona P, Julià E, Tortola MT, Audí L, Oksenberg JR, Martin R, Montalban X, Comabella M (2010). "Gender-Associated Differences of Perforin Polymorphisms in the Susceptibility to Multiple Sclerosis". J Immunol 185 (9): 5392–404. PMID 20921521.
- ↑ Andrin C, Pinkoski MJ, Burns K; et al. (xullo de 1998). "Interaction between a Ca2+-binding protein calreticulin and perforin, a component of the cytotoxic T-cell granules". Biochemistry 37 (29): 10386–94. PMID 9671507. doi:10.1021/bi980595z.
