Forma L bacteriana

As formas L bacterianas, bacterias de forma L, formas L (ou tamén bacterias en fase L, variantes de fase L, ou bacterias deficientes en parede celular ) son cepas de bacterias que carecen de parede celular, pero que derivan de bacterias que normalmente teñen parede.[1] Foron illadas por primeira vez en 1935 por Emmy Klieneberger-Nobel, que as denominou "formas L" tomando para o nome a inicial do Instituto Lister de Londres onde ela estaba traballando.[2]
Distínguense dous tipos de formas L: formas L inestables, que son esferoplastos que se poden dividir, pero que poden reverter á súa morfoloxía orixinal, e formas L estables, que son formas L incapaces de reverter á súa forma bacteriana orixinal.
Algunhas especies parasitas de bacterias, como os micoplasmas, tamén carecen de parede celular,[3] pero non se consideran formas L, xa que non derivan de bacterias que normalmente teñan parede celular.[4]
Aparencia e división celular[editar | editar a fonte]
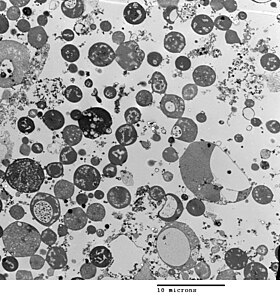

A morfoloxía bacteriana está determinada pola parede celular. Como as formas L non teñen parede celular, a súa morfoloxía é diferente á das cepas de bacterias das cales derivan. As células de formas L típicas son esferas ou esferoides. Por exemplo, as formas L da bacteria de morfoloxía bacilar Bacillus subtilis son redondas cando se ven con microscopía de contraste de fase ou con microscopio electrónico de transmisión.[5]
Aínda que as formas L poden desenvolverse a partir de bacterias grampositivas ou de gramnegativas, as formas L sempre se tinguen como gramnegativas na tinguidura de Gram, debido á súa falta de parede celular.
A parede celular é importante para a división celular, a cal, na maioría das bacterias, ocorre por fisión binaria. A falta de parede celular nas formas L significa que a súa división é desorganizada, o que dá lugar a unha variedade de tamaños celulares, desde moi diminutos a outros relativamente grandes.
Nas bacterias a división ccelular xeralmente require a existencia da parede celular e compoñentes do citoesqueleto bacteriano como FtsZ. A capacidade das bacterias de forma L de crecer e dividirse en ausencia de ambas os elementos é moi pouco usual, e pode representar unha forma de división que era importante nas primeiras formas de vida que apareceron na Terra.[1] A súa forma de división celular parece consistir na extensión desde a superficie da célula de finas protrusións, as cales despois se evaxinan e desprenden para formar novas células.
Xeración en cultivos[editar | editar a fonte]
As formas L poden xerarse no laboratorio a partir de moitas especies bacterianas que xeralmente teñen parede celular, como Bacillus subtilis ou Escherichia coli. Isto faise inhibindo a síntese de peptidoglicano con antibióticos ou tratando as células con lisozima, un encima que dixire as paredes celulares. As formas L xéranse nun medio de cultivo que teña a mesma osmolaridade ca o citosol bacteriano (unha solución isotónica), o cal impide a lise celular por choque osmótico.[2] As cepas L poden ser inestables, e tender a reverter á forma normal desa bacteria ao volverlles a crecer a parede celular, pero isto pode impedirse facendo un cultivo a longo prazo das células baixo as mesmas condicións usadas para producilas.[6]
Algúns estudos identificaron mutacións que orixinan cepas con formas L derivadas das bacterias normais.[1][2] Unha destas mutacións puntuais afecta a un encima implicado na vía do mevalonato do metabolismo lipídico que incrementa a frecuencia da formación de formas L en 1.000 veces.[1] A razón deste efecto non se coñece, pero crese que o incremento da frecuencia está relacionado co papel deste encima en producir un lípido importante para a síntese do peptidoglicano.
Outra metodoloxía de indución da formación de formas L depende da nanotecnoloxía e a ecoloxía de paisaxe. Poden idearse aparellos de microfluídos para impedir a síntese de peptidoglicano por confinamento espacial extremo. Despois da dispersión biolóxica a través dun corredor biolóxico constrinxido (de escala submicrométrica) que conecta parches de microhábitats, poden obterse células do tipo das formas L.[7]
Importancia e aplicacións[editar | editar a fonte]
Algunhas publicacións suxeriron que as bacterias de forma L poderían causar enfermidades en humanos,[8] e outros animais[9] pero esta hipótese é controvertida porque as evidencias que asocian estes microorganismos coas enfermidades é fragmentaria e frecuentemente contraditoria.[10][11] Os dous puntos de vista extremos desta cuestión son que as bacterias de formas L non son máis que curiosidades de laboratorio sen importancia clínica ou ben que son causantes importantes pero desapercibidas de enfermidades.[4] As investigacións sobre as formas L continúan. Por exemplo, observáronse organismos de formas L nos pulmóns de ratos despois da súa inoculación experimental con Nocardia caviae,[12][13] e un estudo recente suxire que estes organismos poden infectar a pacientes inmunosuprimidos que sufriron un transplante de medula ósea.[14] Propúxose tamén que a formación de cepas de bacterias que carecen de paredes celulares é importante para a adquisición de resistencia a antibióticos polas bacterias.[15]
As bacterias de formas L poden ser útiles na investigación das primeiras formas de vida, e en biotecnoloxía. Estas cepas están sendo examinadas para posibles usos en biotecnoloxía como cepas hóspede para a expresión de proteínas recombinantes.[16] A ausencia de parede celular pode permitir a produción de grandes cantidade de proteínas segregadas que doutro modo se acumularían no espazo periplásmico da bacteria.[17][18] A acumulación de proteínas no espazo periplásmico pode ser tóxica para a bacteria, a cal pode reducir o rendemento da produción das proteínas expresadas.
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 1,3 Leaver M, Domínguez-Cuevas P, Coxhead JM, Daniel RA, Errington J (2009). "Life without a wall or division machine in Bacillus subtilis". Nature 457 (7231): 849–53. PMID 19212404. doi:10.1038/nature07742.
- ↑ 2,0 2,1 2,2 Joseleau-Petit D, Liébart JC, Ayala JA, D'Ari R (2007). "Unstable Escherichia coli L Forms Revisited: Growth Requires Peptidoglycan Synthesis". J. Bacteriol. 189 (18): 6512–20. PMC 2045188. PMID 17586646. doi:10.1128/JB.00273-07.
- ↑ Razin S, Yogev D, Naot Y (1998). "Molecular Biology and Pathogenicity of Mycoplasmas". Microbiol. Mol. Biol. Rev. 62 (4): 1094–156. PMC 98941. PMID 9841667.
- ↑ 4,0 4,1 Domingue GJ, Woody HB (1997). "Bacterial persistence and expression of disease". Clin. Microbiol. Rev. 10 (2): 320–44. PMC 172922. PMID 9105757. Full PDF
- ↑ Gilpin RW, Young FE, Chatterjee AN (1973). "Characterization of a Stable L-Form of Bacillus subtilis 168". J. Bacteriol. 113 (1): 486–99. PMC 251652. PMID 4631836.
- ↑ Allan EJ (1991). "Induction and cultivation of a stable L-form of Bacillus subtilis". J. Appl. Bacteriol. 70 (4): 339–43. PMID 1905284. doi:10.1111/j.1365-2672.1991.tb02946.x.
- ↑ Männik J., R. Driessen, P. Galajda, J.E. Keymer, C. Dekker (2009). "Bacterial growth and motility in sub-micron constrictions". PNAS 106 (35): 14861–14866. PMC 2729279. PMID 19706420. doi:10.1073/pnas.0907542106.
- ↑ Wall S, Kunze ZM, Saboor S, Soufleri I, Seechurn P, Chiodini R, McFadden JJ (1993). "Identification of spheroplast-like agents isolated from tissues of patients with Crohn's disease and control tissues by polymerase chain reaction" (PDF). J Clin Microbiol 31 (5): 1241–5. PMC 262911. PMID 8501224.
- ↑ Hulten K, Karttunen TJ, El-Zimaity HM, Naser SA, Collins MT, Graham DY, El-Zaatari FA (2000). "Identification of cell wall deficient forms of M. avium subsp. paratuberculosis in paraffin embedded tissues from animals with Johne's disease by in situ hybridization". J Microbiol Methods 42 (2): 185–95. PMID 11018275. doi:10.1016/S0167-7012(00)00185-8.
- ↑ Onwuamaegbu ME, Belcher RA, Soare C (2005). "Cell wall-deficient bacteria as a cause of infections: a review of the clinical significance" (PDF). J. Int. Med. Res. 33 (1): 1–20. PMID 15651712. Arquivado dende o orixinal (PDF) o 24 de agosto de 2009. Consultado o 06 de xullo de 2013.
- ↑ Casadesús J (2007). "Bacterial L-forms require peptidoglycan synthesis for cell division". BioEssays 29 (12): 1189–91. PMID 18008373. doi:10.1002/bies.20680.
- ↑ Beaman BL (1980). "Induction of L-phase variants of Nocardia caviae within intact murine lungs". Infect. Immun. 29 (1): 244–51. PMC 551102. PMID 7399704.
- ↑ Beaman BL, Scates SM (1981). "Role of L-forms of Nocardia caviae in the development of chronic mycetomas in normal and immunodeficient murine models". Infect. Immun. 33 (3): 893–907. PMC 350795. PMID 7287189.
- ↑ Woo PC, Wong SS, Lum PN, Hui WT, Yuen KY (2001). "Cell-wall-deficient bacteria and culture-negative febrile episodes in bone-marrow-transplant recipients". Lancet 357 (9257): 675–9. PMID 11247551. doi:10.1016/S0140-6736(00)04131-3.
- ↑ Fuller E, Elmer C, Nattress F; et al. (2005). "β-Lactam Resistance in Staphylococcus aureus Cells That Do Not Require a Cell Wall for Integrity". Antimicrob. Agents Chemother. 49 (12): 5075–80. PMC 1315936. PMID 16304175. doi:10.1128/AAC.49.12.5075-5080.2005. Arquivado dende o orixinal o 29 de maio de 2009. Consultado o 06 de xullo de 2013.
- ↑ Gumpert J, Hoischen C (1998). "Use of cell wall-less bacteria (L-forms) for efficient expression and secretion of heterologous gene products". Curr. Opin. Biotechnol. 9 (5): 506–9. PMID 9821280. doi:10.1016/S0958-1669(98)80037-2.
- ↑ Rippmann JF, Klein M, Hoischen C; et al. (1 December 1998). "Procaryotic Expression of Single-Chain Variable-Fragment (scFv) Antibodies: Secretion in L-Form Cells of Proteus mirabilis Leads to Active Product and Overcomes the Limitations of Periplasmic Expression in Escherichia coli". Appl. Environ. Microbiol. 64 (12): 4862–9. PMC 90935. PMID 9835575.
- ↑ Choi JH, Lee SY (2004). "Secretory and extracellular production of recombinant proteins using Escherichia coli". Appl. Microbiol. Biotechnol. 64 (5): 625–35. PMID 14966662. doi:10.1007/s00253-004-1559-9.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Errington Group at Newcastle University
- Os científicos exploran unha nova fiestra na orixe da vida 2009 Newcastle University press release
Outros artigos[editar | editar a fonte]
- Protoplasto
- Esferoplasto
- Mycoplasmataceae — carecen de peptidoglicano pero teñen unha capa de ácido micólico para darlles estabilidade
- Ultramicrobacteria
Bibliografía[editar | editar a fonte]
- Domingue, Gerald J. (1982). Cell wall-deficient bacteria: basic principles and clinical significance. Reading, Mass: Addison-Wesley Pub. Co. ISBN 0-201-10162-9.
- Mattman, Lida H. (2001). Cell wall deficient forms: stealth pathogens. Boca Raton: CRC. ISBN 0-8493-8767-1.
