Ficoeritrina
| Ficoeritrina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Phycoerythr_ab | ||||||||
| Pfam | PF02972 | ||||||||
| InterPro | IPR004228 | ||||||||
| SCOPe | 1qgw / SUPFAM | ||||||||
| |||||||||
A ficoeritrina (PE) é un complexo proteína-pigmento vermello da familia das ficobiliproteínas captadoras de luz, presente nas algas vermellas[1] e criptófitas,[2], que funciona como un pigmento accesorio para a clorofila durante a fotosíntese.
Como todas as ficobiliproteínas, está composta por unha parte proteica que está covalentemente unida a uns cromóforos chamados ficobilinas. Na familia da ficooeritrina, as ficobilinas máis comúns son: ficoeritrobilina, que é o cromóforo aceptor máis típico na ficoeritrina, e máis raramente a ficourobilina. As ficoeritrinas están compostas por monómeros (αβ), que xeralmente se dispoñen formando un trímero con forma de disco (αβ)3 ou un hexámero (αβ)6 (o segundo é a unidade funcional das barras antena). Estes complexo típicos conteñen tamén un terceiro tipo de subunidade, a cadea γ.[1]
Son as ficobiliproteínas que se unen ao maior número de ficobilinas (ata dez por monómero αβ).
Ficobilisomas[editar | editar a fonte]
- Artigo principal: Ficobilisoma.

As ficobiliproteínas son parte de enormes complexos proteicos antena captadores de luz chamados ficobilisomas. Nas algas vermellas están ancorados no lado estromal das membrana dos tilacoides dos cloroplastos, mentres que nas criptófitas os ficobilisomas son reducidos (aquí son moléculas de ficobiliproteína 545 PE545) e están densamente empaquetadas dentro do lume dos tilacoides.[2][4]
A ficoeritrina é un pigmento accesorio para o principal pigmento responsable da fotosíntese, que é a clorofila. A enerxía da luz é captada pola ficoeritrina e despois é cedida ao par de clorofilas do centro de reacción, a maior parte das veces por medio das ficobiliproteínas ficocianina e aloficocianina.
Características estruturais[editar | editar a fonte]
As ficoeritrinas agás a ficoeritrina 545 (PE545) están compostas por monómeros (αβ) ensamblados en hexámeros con forma de disco (αβ)6 ou trímeros (αβ)3 con simetría 32 ou 3, que encerran un canal central. Nos ficobilisomas (PBS) cada trímero ou hexámero contén como mínimo unha proteína de enlace localizada no canal central. A B-ficoeritrina (B-PE) e a R-ficoeritrina (R-PE) das algas vermellas ademais das cadeas α e β teñen unha terceira cadea chamada subunidade γ que é unha cadea que combina as funcións de enlace e de captación de luz, xa que leva cromóforos.[1]

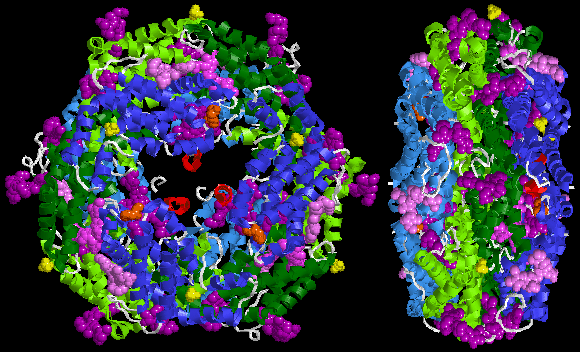
A R-ficoeritrina (R-PE) é producida predominantemente polas algas vermellas. A proteína consta polo menos de tres subunidades diferentes e varía segundo a especie. A estrutura da subunidade da R-ficoeritrina máis común é (αβ)6γ. A subunidade α ten dúas ficoeritrobilinas (PEB), a subunidade β ten 2 ou 3 ficoeritrobilinas e unha ficourobilina (PUB), mentres que as subunidades gamma teñen 3 ficoeritrobilinas e dúas ficourobilinas (γ1) ou 1 ou 2 ficoeritrobilinas e 1 ficourobilina (γ2). O peso molecular da R-ficoeritrina é de 250.000 Da.
As estruturas cristalinas dispoñibles no Protein Data Bank [7] conteñen unha unidade asimétrica (αβ)2 ou (αβγ)2 de diferentes ficoeritrinas:


| Cromóforo ou outra molécula non proteica |
Ficoeritrina | Cadea | |||
|---|---|---|---|---|---|
| PE545 | B-PE | R-PE | outros tipos | ||
| Bilinas | 8 | 10 | 10 | 10 | α e β |
| - Ficoeritrobilina (PEB) | 6 | 10 | 0 ou 8 | 8 | β (PE545) or α e β |
| - 15,16-dihidrobiliverdina (DBV) | 2 | - | - | - | α (-3 e -2) |
| - Ficocianobilina (CYC) | - | - | 8 ou 7 ou 0 | - | α e β |
| - Biliverdina IX alfa (BLA) | - | - | 0 ou 1 | - | α |
| - Ficourobilina (PUB) | - | - | 2 | 2 | β |
| 5-hidroxilisina (LYZ) | 1 ou 2 | - | - | - | α (-3 ou -3 e -2) |
| N-metil asparaxina (MEN) | 2 | 2 | 0 ou 2 | 2 | β |
| Ión sulfato SO42- (SO4) | - | 5 ou 1 | 0 ou 2 | - | α ou α e β |
| Ión cloruro Cl- (CL) | 1 | - | - | - | β |
| Ión magnesio Mg2+ (MG) | 2 | - | - | - | α-3 e β |
| ficheiros PDB inspeccionados | 1XG0 1XF6 1QGW |
3V57 3V58 |
1EYX 1LIA 1B8D |
2VJH | |
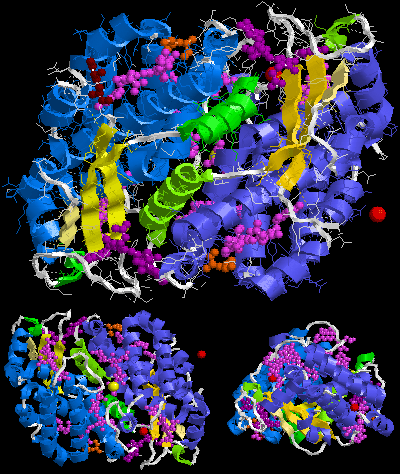
A molécula biolóxica asumida de ficoeritrina 545 (PE545) é (αβ)2 ou máis ben (α3β)(α2β). Os números 3 e 2 despois de α na segunda fórmula son parte dos nomes da cadea aquí, non as súas cantidades. O nome sinónimo nas criptófitas da cadea α3 é cadea α1.
A ensamblaxe máis grande de B-ficoeritrina (B-PE) é o trímero (αβ)3 PDB 3V57[5], pero en preparacións de algas vermellas obtívose tamén o hexámero (αβ)6 [1]. No caso da R-ficoeritrina (R-PE) a molécula máis grande asumida aquí é (αβγ)6, (αβγ)3(αβ)3 ou (αβ)6 dependendo da publicación, para outros tipos de ficoeritrina (αβ)6. Estas cadeas γ de Protein Data Bank son moi pequenas e constan só de 6 ou 3 aminoácidos recoñecibles (PDB 1EYX)[9], mentres que a cadea de enlace γ descrita ao inicio desta sección é grande (por exemplo de 277 aminoácidos e 33 kDa no caso da γ33 da alga vermella Aglaothamnion neglectum) [1][10]. Isto débese a que por problemas cristalográficos só poden modelarse uns poucos aminoácidos (PDB 1EYX [9] PDB 1B8D [11]).
Para (αβγ)6, (αβ)6 ou (αβγ)3(αβ)3 os valores da táboa deberían simplemente multiplicarse por 3, (αβ)3 contén números intermedios de moléculas non proteicas.
Nas ficoeritrinas PE545 de arriba, unha cadea α (-2 ou -3) únese a 1 molécula de bilina, noutros exemplos 2 moléculas de cadea β sempre 3 moléculas, que a pequena cadea γ ningunha.
Dúas moléculas de N-metil asparaxina únense á cadea β, unha 5-hidroxilisina á α (-3 ou -2), un Mg2+ á α-3 e β, un Cl- á β, 1-2 moléculas de SO42- á α ou β.
Debaixo a estrutura cristalina da R-ficoeritrina de Protein Data Bank:

Características espectrais[editar | editar a fonte]

Os picos de absorción no espectro da luz visible aparecen a 495 e 545/566 nm, dependendo dos cromóforos que leven unidos e o organismo considerado. Hai un forte pico de emisión a 575 ± 10 nm. (é dicir, a ficoeritrina absorbe luz azul-verdosa/amarelenta e emite luz laranxa-amarela).
| Máximo de absorción | 565 nm |
| Pico de absorción adicional | 498 nm |
| Máximo de emisión | 573 nm |
| Coeficiente de extinción (ε) | 1.96 x 106 M−1cm−1 |
| Rendemento cuántico (QY) | 0.84 |
| Brillo (ε x QY) | 1.65 x 106 M−1cm−1 |
As bilinas PEB e DBV en PE545 absorben na rexión do espectro verde tamén, cuns máximos a 545 e 569 nm respectivamente. O máximo de emisión de fluorescencia é a 580 nm.[2]
Variacións da R-ficoeritrina[editar | editar a fonte]

Como se mencionou anteriormente, a ficoeritrina pode encontrarse en diversas especies de algas. Hai variacións na eficiencia da absorbancia e emisión de luz requirida para a facilitación da fotosíntese. Este podería ser o resultado do lugar da columna de auga onde vive unha determinada especie de alga e como consecuencia da necesidade dunha maior ou menor eficiencia dos pigmentos accesorios.
Cos avances nas tecnoloxías de detección e da imaxe que poden evitar o fotobranqueamento rápido, os fluoróforos de proteínas convertéronse nunha ferramenta potente e viable para os investigadores en campos como a microscopía, análise de micromatrices e aplicación da técnica do western blot. Tendo en conta isto, pode ser útil para os investigadores cribar estas R-ficoeritrinas variables para determinar cal é a máis apropiada para a súa aplicación particular. Mesmo un pequeno incremento na eficiencia da fluorescencia podería reducir o ruído de fondo e rebaixar o grao de resultados de falso negativo.
Aplicacións[editar | editar a fonte]
A R-ficoeritrina é útil no laboratorio como un indicador baseado na fluorescencia da presenza de cianobacterias e para etiquetar anticorpos na inmunofluorescencia, entre outras aplicacións. Hai tamén outros tipos de ficoeritrinas, como a B-ficoeritrina, que ten propiedades espectrais lixeiramente diferentes. A B-ficoeritrina absorbe fortemente nos 545 nm (cor verde amarelenta) e emite fortemente a 572 nm (amarelo) o que podería ser mellor para algúns instrumentos. A B-ficoeritrina pode tamén ser menos "pegañenta" que a R-ficoeritrina e contribúe menos ao sinal de fondo debido a unións non específicas en certas aplicacións.
A R-ficoeritrina e a B-ficoeritrina están entre as tinguiduras fluorescentes máis brillantes que foron identificadas.
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 1,3 1,4 Ficner R., Huber R. (1993). "Refined crystal structure of phycoerythrin from Porphyridium cruentum at 0.23-nm resolution and localization of the γ subunit.". Eur. J. Biochem. 218 (1): 103–106. PMID 8243457. doi:10.1111/j.1432-1033.1993.tb18356.x. Consultado o 13 October 2012.
- ↑ 2,0 2,1 2,2 van der Weij-De Wit C. D., Doust A. B., van Stokkum I. H. M., Dekker J. P., Wilk K. E., Curmi P. M. G., Scholes G. D., van Grondelle R. (2006). "How Energy Funnels from the Phycoerythrin Antenna Complex to Photosystem I and Photosystem II in Cryptophyte Rhodomonas CS24 Cells." (PDF). J. Phys. Chem. B. 110: 25066–25073. PMID 17149931. doi:10.1021/jp061546w. Arquivado dende o orixinal (PDF) o 30 de outubro de 2013. Consultado o 13 October 2012.
- ↑ Christophe Six, Jean-Claude Thomas, Laurence Garczarek, Martin Ostrowski, Alexis Dufresne, Nicolas Blot, David J Scanlan and Frédéric Partensky (2007). "Diversity and evolution of phycobilisomes in marine Synechococcus spp.: a comparative genomics study". Genome Biology. 8:R259 (12). doi:10.1186/gb-2007-8-12-r259. Arquivado dende o orixinal o 17 de abril de 2014. Consultado o 16 April 2014.
- ↑ Glazer A. N. (1985). "Light Harvesting by Phycobilisomes.". Annual Review of Biophysics and Biophysical Chemistry 14: 47–77. PMID 3924069. doi:10.1146/annurev.bb.14.060185.000403. Consultado o 13 October 2012.
- ↑ 5,0 5,1 Camara-Artigas, A., Bacarizo, J., Andujar-Sanchez, M., Ortiz-Salmeron, E., Mesa-Valle, C., Cuadri, C., Martin-Garcia, J.M., Martinez-Rodriguez, S., Mazzuca-Sobczuk, T., Ibanez, M.J., Allen, J.P. (2012). "pH-dependent structural conformations of B-phycoerythrin from Porphyridium cruentum.". Febs J. 279: 3680–3691. PMID 22863205. doi:10.1111/j.1742-4658.2012.08730.x. PDB ID: 3V57. Consultado o 12 October 2012.
- ↑ 6,0 6,1 6,2 6,3 Image created with RasTop (Molecular Visualization Software).
- ↑ "Protein Data Bank". RCSB Protein Data Bank (PDB). Arquivado dende o orixinal o 28 de agosto de 2008. Consultado o 12 October 2012.
- ↑ Doust, A.B., Marai, C.N.J., Harrop, S.J., Wilk, K.E., Curmi, P.M.G., Scholes, G.D. (2004). "Developing a structure-function model for the cryptophyte phycoerythrin 545 using ultrahigh resolution crystallography and ultrafast laser spectroscopy.". J.Mol.Biol. 344: 135–153. PMID 15504407. doi:10.1016/j.jmb.2004.09.044. PDB ID: 1XG0. Consultado o 11 October 2012.
- ↑ 9,0 9,1 9,2 9,3 Contreras-Martel, C., Martinez-Oyanedel, J., Bunster, M., Legrand, P., Piras, C., Vernede, X., Fontecilla-Camps, J.C. (2001). "Crystallization and 2.2 A resolution structure of R-phycoerythrin from Gracilaria chilensis: a case of perfect hemihedral twinning.". Acta Crystallogr.,Sect.D 57: 52–60. PMID 11134927. doi:10.1107/S0907444900015274. PDB ID: 1EYX. Consultado o 11 October 2012.
- ↑ Apt K. E., Hoffman N. E., Grossman A. R. (1993). "The γ Subunit of R-phycoerythrin and Its Possible Mode of Transport into the Plastiodf Red Algae.". J Biol Chem. 268 (22): 16208–16215. PMID 8344905. Consultado o 13 October 2012.
- ↑ Ritter, S., Hiller, R.G., Wrench, P.M., Welte, W., Diederichs, K. (1999). "Crystal structure of a phycourobilin-containing phycoerythrin at 1.90-A resolution.". J.Struct.Biol. 126: 86–97. PMID 10388620. doi:10.1006/jsbi.1999.4106. PDB ID: 1B8D. Consultado o 14 October 2012.
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Phycoerythrin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
