Ferredoxina-NADP+ redutase
| ferredoxina-NADP+ redutase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 1.18.1.2 | ||||||||
| Número CAS | 9029-33-8 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A ferredoxina-NADP+ redutase, abreviada como FNR é un encima (co número EC 1.18.1.2) que cataliza a última reacción da fase luminosa da fotosíntese na que se reduce o NADP+, segundo a seguinte reacción:
- 2 ferredoxina reducida + NADP+ + H+ 2 ferredoxina oxidada + NADPH
Os tres substratos deste encima son: ferredoxina reducida, NADP+, e H+. O encima utiliza o cofactor a flavínico FAD, polo que é unha flavoproteína. Pertence á familia das oxidorredutases, que utilizan como doantes de electróns proteínas ferro-sulfuradas, e como aceptores de electróns os coencimas NADP+ ou NAD+.
Nomenclatura[editar | editar a fonte]
O nome sistemático desta clase de encimas é ferredoxina:NADP+ oxidorredutase. Ademais dos nomes xa mencionados, outros nomes que se utilizan son:
- adrenodoxina redutase,
- ferredoxina-TPN redutase,
- NADP+:ferredoxina oxidorredutase,
- NADPH:ferredoxina oxidorredutase,
- NADPH-adrenodoxina redutase
- TPNH-ferredoxina redutase
Mecanismo[editar | editar a fonte]
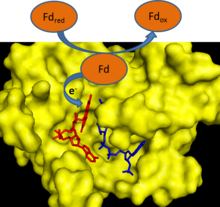
Durante a fotosíntese, os electróns que se desprenden de moléculas de auga na fase luminosa acaban sendo transferidos ao transportador de electróns ferredoxina, que só pode captar un electrón. Dúas destas moléculas de ferredoxina ceden un electrón cada unha á ferredoxina-NADP+ redutase (FNR), que os transfire a unha soa molécula de NADPH.[1] A FNR utiliza o FAD, que pode existir en tres posibles estados: oxidado, como semiquinona reducida cun só electrón, ou como FADH2 (completamente reducido), e que pode mediar na trasnferencia de electróns.[2]
A FNR ten un mecanismo de catálise por axuste inducido.[2] A unión da ferredoxina ao encima causa a formación dun enlace de hidróxeno entre un residuo de glutamato (GLU312) e un residuo de serina (SER96) no seu sitio activo.[3] O residuo de glutamato está moi conservado entre as especies, porque estabiliza a forma semiquinona do FAD e ademais é un doante/aceptor de protóns na reacción.[4] O paso limitante na reacción de transferencia de electróns é a liberación da primeira molécula de ferredoxina oxidada despois da redución do FAD cun electrón.[2] Este paso é inhibido pola presenza de ferredoxina oxidada e estimulado pola presenza de NADP+.[2] A unión do NADP+ ao encima fai diminuír a afinidade do encima pola ferredoxina.[5]
Esta reacción pode tamén operar á inversa e xerar ferredoxina reducida, a cal pode despois utilizarse en varias vías biosintéticas. Algunhas bacterias e algas utilizan a molécula flavodoxina en lugar da ferredoxina como a molécula transportadora dun só electrón.[2]
Estrutura[editar | editar a fonte]

Nas plantas a ferredoxina-NADP+ redutase ten dous dominios estruturais. O primeiro dominio é un barril beta antiparalelo no extremo amino terminal da proteína, que contén o dominio de unión para o cofactor FAD.[6] O segundo dominio está no extremo carboxilo terminal da proteína e contén un pregamento hélice alfa-lámina beta.[6] Neste dominio terminal é onde se une o NADP+.[7] O sitio activo do encima atópase na interface entre os dous dominios.[8]
A unión do encima á membrana do tilacoide implica unha zona con hélice de poliprolina tipo II formada entre dous monómeros de FNR e varias proteínas integrais de membrana ricas en prolina.[9]
Funcións[editar | editar a fonte]
A ferredoxina-NADP+ redutase é o último encima que actúa durante a transferencia de electróns fotosintética desde o fotosistema I ao NADPH,[1] polo que é fundamental para a fotorredución do NADP+ na que se obtén o poder redutor na fase luminosa da fotosíntese. O NADPH é despois utilizado como equivalente de redución nas reaccións do ciclo de Calvin (fase escura).[1] A circulación de electróns desde a ferredoxina ao NADPH só ocorre nos períodos de luz en parte porque a actividade da FNR é inhibida na escuridade.[10]
Nos organismos non fotosintéticos que teñen este encima, a FNR funciona principalmente á inversa para producir ferredoxina reducida para usala en varias vías metabólicas. Entre estas vías están a fixación do nitróxeno, biosíntese de terpenoides, metabolismo de esteroides, resposta ao estrés oxidativo, e bioxénese de proteínas ferro-sulfuradas.[6]
A FNR é unha proteína soluble que se encontra libre no estroma do cloroplasto ou unida á membrana do tilacoide. Esta unión ten lugar en fronte do sitio activo do encima e non parece que afecte á estrutura do sitio activo ou teña un impacto significativo sobre a actividade do encima.[9] Cando se une á membrana do tilacoide, o encima está en forma de dímero, pero cando está libre no estroma, é un monómero.[9] A unión da FNR a proteínas integrais da membrana do tilacoide está favorecida en condicións ácidas, polo que o recrutamento e unión da FNR á membrana tilacoidal pode ser un método de almacenar e estabilizar o encima durante a escuridade, cando a fotosíntese non pode ter lugar.[11] O pH do estroma do cloroplasto varía desde lixeiramente ácido na escuridade a máis alcalino durante os períodos de luz.[9] Por tanto, na escuridade, serán recrutadas máis FNRs e unidas á membrana do tilacoide, e na luz disociaranse da membrana máis FNRs e quedarán libres no estroma.
Evolución[editar | editar a fonte]
As ferredoxinas-NADP+ redutases están presentes en moitos organismos, como plantas, bacterias, e nas mitocondrias dos eucariotas. Porén, estas proteínas pertencen a dúas familias proteicas non relcionadas e son un exemplo de evolución converxente.[6] As FNRs do tipo vexetal inclúen as FNRs de plastos das plantas e as FNRs bacterianas.[6] As FNRs do tipo glutatión redutase son as que aparecen nas mitocondrias eucariotas e son bastante diferentes ás anteriores.[6]
Na familia das FNRs do tipo das plantas, a presión selectiva evolutiva orixinou diferenzas na eficiencia catalítica das FNRs nos organismos fotosintéticos e non fotosintéticos. A transferencia de electróns feita pola FNR é un paso limitante da fotosíntese, polo que as FNR dos plastos das plantas evolucionaron adquirindo grande eficiencia.[7] Estes FNRs de plastos son de 20 a 100 veces máis activos cós FNRs bacterianos.[12] Esta alta eficiencia catalítica da transferencia de electróns entre o FAD e o NADP+ está relacionada con cambios estruturais no sitio activo que reducen a distancia entre o N5 do FAD e o C4 do NADP+.[13]
As FNRs dos plastos das plantas evolucionaron tamén cara a ter un alto grao de especificidade de substrato polo NADP+ en comparación co NAD+; e estudos das mutacións nos seus aminoácidos indicaron que o residuo de tirosina terminal nas FNRs de plastos xoga un papel chave nesta especificidade de substrato.[7] A diferenza do anterior, algunhas FNRs non fotosintéticas non se unen preferencialmente ao NADP+ e carecen dese residuo de tirosina.[13]
Parasitos con FNR[editar | editar a fonte]
Varias enfermidades humanas importantes están causadas por protozoos parasitos intracelulares obrigados do filum Apicomplexa, que teñen FNR. O orgánulo chamado apicoplasto destes organismos crese que se orixinou por endosimbiose entre un protozoo ancestral e unha alga fagocitada.[6] Estes apicoplastos conteñen FNR similares aos de plantas que o protozoo usa para xerar ferredoxina reducida, a cal será usada despois en rutas metabólicas redutivas esenciais.[14] Foron secuenciadas as FNRs de dous importantes parasitos dos humanos como son o Plasmodium falciparum, que causa a malaria, e o Toxoplasma gondii, que causa a toxoplasmose.[15] Como os humanos non teñen unha proteína homóloga á FNR, estes encimas poden utilizarse como posibles novas dianas para fármacos terapéuticos contra esas doenzas.[15]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). W.H. Freeman, ed. Biochemistry (6th ed.). New York. ISBN 0-7167-8724-5.
- ↑ 2,0 2,1 2,2 2,3 2,4 Carrillo, N.; Ceccarelli, EA. (2003). "Open questions in ferredoxin-NADP+ reductase catalytic mechanism.". Eur J Biochem 270 (9): 1900–15. PMID 12709048. doi:10.1046/j.1432-1033.2003.03566.x.
- ↑ Kurisu, G.; Kusunoki, M.; Katoh, E.; Yamazaki, T.; Teshima, K.; Onda, Y.; Kimata-Ariga, Y.; Hase, T. (2001). "Structure of the electron transfer complex between ferredoxin and ferredoxin-NADP(+) reductase.". Nat Struct Biol 8 (2): 117–21. PMID 11175898. doi:10.1038/84097.
- ↑ Dumit, VI.; Essigke, T.; Cortez, N.; Ullmann, GM. (2010). "Mechanistic insights into ferredoxin-NADP(H) reductase catalysis involving the conserved glutamate in the active site.". J Mol Biol 397 (3): 814–25. PMID 20132825. doi:10.1016/j.jmb.2010.01.063.
- ↑ Medina, M. (2009). "Structural and mechanistic aspects of flavoproteins: photosynthetic electron transfer from photosystem I to NADP+.". FEBS J 276 (15): 3942–58. PMID 19583765. doi:10.1111/j.1742-4658.2009.07122.x.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 Aliverti, A.; Pandini, V.; Pennati, A.; de Rosa, M.; Zanetti, G. (2008). "Structural and functional diversity of ferredoxin-NADP(+) reductases.". Arch Biochem Biophys 474 (2): 283–91. PMID 18307973. doi:10.1016/j.abb.2008.02.014.
- ↑ 7,0 7,1 7,2 Paladini, DH.; Musumeci, MA.; Carrillo, N.; Ceccarelli, EA. (2009). "Induced fit and equilibrium dynamics for high catalytic efficiency in ferredoxin-NADP(H) reductases.". Biochemistry 48 (24): 5760–8. PMID 19435322. doi:10.1021/bi9004232.
- ↑ Arakaki, AK.; Ceccarelli, EA.; Carrillo, N. (1997). "Plant-type ferredoxin-NADP+ reductases: a basal structural framework and a multiplicity of functions.". FASEB J 11 (2): 133–40. PMID 9039955. PMID 9039955
- ↑ 9,0 9,1 9,2 9,3 Alte, F.; Stengel, A.; Benz, JP.; Petersen, E.; Soll, J.; Groll, M.; Bölter, B. (2010). "Ferredoxin:NADPH oxidoreductase is recruited to thylakoids by binding to a polyproline type II helix in a pH-dependent manner.". Proc Natl Acad Sci U S A 107 (45): 19260–5. PMID 20974920. doi:10.1073/pnas.1009124107.
- ↑ Talts, E.; Oja, V.; Rämma, H.; Rasulov, B.; Anijalg, A.; Laisk, A. (2007). "Dark inactivation of ferredoxin-NADP reductase and cyclic electron flow under far-red light in sunflower leaves.". Photosynth Res 94 (1): 109–20. PMID 17665150. doi:10.1007/s11120-007-9224-7. PMID 17665150
- ↑ Benz, JP.; Lintala, M.; Soll, J.; Mulo, P.; Bölter, B. (2010). "A new concept for ferredoxin-NADP(H) oxidoreductase binding to plant thylakoids.". Trends Plant Sci 15 (11): 608–13. PMID 20851663. doi:10.1016/j.tplants.2010.08.008.
- ↑ Orellano, EG.; Calcaterra, NB.; Carrillo, N.; Ceccarelli, EA. (1993). "Probing the role of the carboxyl-terminal region of ferredoxin-NADP+ reductase by site-directed mutagenesis and deletion analysis.". J Biol Chem 268 (26): 19267–73. PMID 8366077. PMID 8366077
- ↑ 13,0 13,1 Peregrina, JR.; Sánchez-Azqueta, A.; Herguedas, B.; Martínez-Júlvez, M.; Medina, M. (2010). "Role of specific residues in coenzyme binding, charge-transfer complex formation, and catalysis in Anabaena ferredoxin NADP+-reductase.". Biochim Biophys Acta 1797 (9): 1638–46. PMID 20471952. doi:10.1016/j.bbabio.2010.05.006.
- ↑ Balconi, E.; Pennati, A.; Crobu, D.; Pandini, V.; Cerutti, R.; Zanetti, G.; Aliverti, A. (2009). "The ferredoxin-NADP+ reductase/ferredoxin electron transfer system of Plasmodium falciparum.". FEBS J 276 (14): 3825–36. PMID 19523113. doi:10.1111/j.1742-4658.2009.07100.x.
- ↑ 15,0 15,1 Seeber, F.; Aliverti, A.; Zanetti, G. (2005). "The plant-type ferredoxin-NADP+ reductase/ferredoxin redox system as a possible drug target against apicomplexan human parasites.". Curr Pharm Des 11 (24): 3159–72. PMID 16178751. PMID 16178751
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Omura T, Sanders E, Estabrook RW, Cooper DY and Rosenthal O (1966). "Isolation from adrenal cortex of a nonheme iron protein and a flavoprotein functional as a reduced triphosphopyridine nucleotide-cytochrome P-450 reductase". Arch. Biochem. Biophys. 117: 660–673. doi:10.1016/0003-9861(66)90108-1.
- Shin M, Tagawa K and Arnon DI (1963). "Crystallization of ferredoxin-TPN reductase and its role in the photosynthetic apparatus of chloroplasts". Biochem. Z. 338: 84–96. PMID 14087348. PMID 14087348.

