Carbamato
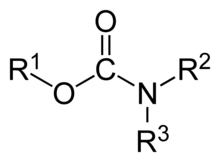
Os carbamatos son compostos orgánicos derivados do ácido carbámico (NH2COOH). Tanto os carbamatos, coma os ésteres de carbamato, e os ácidos carbámicos son grupos funcionais que se encontran interrelacionados estruturalmente e poden ser interconvertidos quimicamente. Os ésteres de carbamato tamén se chaman uretanos.
Síntese[editar | editar a fonte]
Os ácidos carbámicos son derivados de aminas:
- R2NH + CO2 → R2NCO2H
O ácido carbámico é case tan ácido coma o ácido acético. A ionización dun protón xera o anión carbamato, que é a base conxugada do ácido carbámico:
- R2NCO2H → R2NCO2- + H+
Os carbamatos tamén se poden obter a partir da hidrólise de cloroformamidas:
- R2NC(O)Cl + H2O → R2NCO2H + HCl
Tamén poden obterse por medio dun rearranxo de Curtius, no cal se fai reaccionar un isocianato cun alcohol.
- RNCO + R'OH → RNHCO2R'
Aplicacións[editar | editar a fonte]
Este artigo trata principalmente dos carbamatos orgánicos, pero tamén hai sales inorgánicos importantes que son carbamatos, como o carbamato de amonio é producido en grande escala como intermediario químico na produción do produto agroquímico urea a partir do amoníaco e do dióxido de carbono.
Os carbamatos en bioquímica[editar | editar a fonte]
Os grupos amino N-terminais dos residuos de valina das cadeas α- β- da desoxihemoglobina existen en forma de carbamatos. Isto axuda a estabilizar a proteína mentres se transforma en desoxihemoglobina e aumenta a súa tendencia a liberar o oxíxeno remanente que aínda se encontra unido á proteína. A influencia destes carbamatos na afinidade da hemoglobina polo O2 determina o efecto Bohr.
Os grupos ε-amino dos residuos de lisina na urease e fosfotriesterase tamén se presentan como carbamatos. O carbamato derivado do aminoimidazol é un intermediario na biosíntese da inosina. A partir da degradación metanoxénica do carboxifosfato xérase carbamil fosfato en vez de CO2.[1]
Captura do CO2 por medio da ribulosa 1,5-bisfosfato carboxilase[editar | editar a fonte]
O carbamato máis importante na natureza é quizais o que está implicado na captación (fixación) do CO2 durante a fotosíntese, xa que este proceso é o inicio de case todas as cadeas tróficas na natureza e resulta entre outras cousas relevante para o quecemento global. O encima RuBisCO (Ribulosa 1,5-bisfosfato carboxilase/oxixenase) fixa unha molécula de dióxido de carbono en forma de carbamato ao comezo do ciclo de Calvin. No sitio activo do encima, atópase un ión Mg2+ unido a uns residuos dos aminoácidos ácido glutámico, ácido aspártico e lisina, esta última en forma de carbamato. O carbamato fórmase cando a cadea lateral de lisina non cargada próxima ao ión reacciona cunha molécula de dióxido de carbono procedente do aire, o que causa que esta adquira carga e por conseguinte se poida unir ao ión Mg2+.
Carbamatos de uso comercial[editar | editar a fonte]
Insecticidas de tipo carbamato[editar | editar a fonte]
Os chamados insecticidas carbamato presentan un grupo funcional formado por un éster carbamato. Incluídos neste grupo se encontran por exemplo o aldicarb, carbofurano (Furadan), fenoxicarb, carbaril (Sevin), ethienocarb, e fenobucarb. Estes insecticidas matan insectos causando a inactivacion reversible do encima acetilcolinesterase. Os insecticidas organofosforados tamén inhiben este encima, aínda que o fan de maneira irreversible, e, polo tanto, causan un envelenamento e unha síndrome colinérxica moito máis graves.[2]
O repelente para insectos icaridin é un carbamato substituído.
Poliuretanos[editar | editar a fonte]
- Artigo principal: Poliuretano.
Os poliuretanos conteñen múltiples grupos carbamato (uretanos) como parte da súa estrutura, pero, malia o seu nome, o composto uretano (etil carbamato) non é compoñente dos poliuretanos nin se usa na súa produción. Estes compostos poliméricos presentan un amplo rango de propiedades e encóntranse dispoñibles comercialmente en forma de escumas, elastómeros e sólidos. Obtéñense facendo reaccionar diferentes tipos de alcohois con isocianato:
- RN=C=O + R'OH → RNHC(O)OR'
Os polímeros obtéñense ao combinar diferentes diisocianatos, por exemplo, diisocianato de tolueno e dioles, como pode ser o bisfenol-A.
Aditivos[editar | editar a fonte]
O iodopropinil butilcarbamato é un aditivo utilizado coa madeira, pinturas e cosméticos.[3]
Utilizados en medicina humana[editar | editar a fonte]
O uretano ou etil carbamato foi utilizado hai tempo nos Estados Unidos como axente antineoplásico e para outros propósitos medicinais. Pero finalmente se concluíu que resultaba demasiado tóxico e a longo prazo ineficaz.[4] Tamén foi utilizado ocasionalmente en medicina veterinaria.
Algúns outros carbamatos son utilizados habitualmente en farmacoterapia, como por exemplo os inhibidores da colinesterase neostigmina e rivastigmina, que teñen estruturas químicas baseadas no alcaloide natural fisostigmina. Outros exemplos son o meprobamato e os seus derivados tales como o carisoprodol, felbamato, e tibamato. Todos eles son un grupo de ansiolíticos e relaxantes musculares moi utilizados na década de 1960, antes da aparición das benzodiacepinas, e que aínda se utilizan nalgúns casos hoxe.
Análogos sulfurados[editar | editar a fonte]
Nun carbamato hai dous átomos de oxíxeno (figura 1), ROC(=O)NR2, e en teoría calquera dos dous pode ser substituído por xofre. Os análogos de carbamatos nos cales un dos dous oxíxenos é substituído por un átomo de xofre son chamados tiocarbamatos (2 e 3). Os carbamatos nos cales ambos os átomos de oxíxeno foron substituídos por átomos de xofre denomínanse ditiocarbamatos (4), RSC(=S)NR2.
Existen dous tipos de isómeros estruturais do tiocarbamato:
- O-tiocarbamatos (2), ROC(=S)NR2, nos cales o grupo carbonilo (C=O) é substituído por un grupo tiocarbonilo (C=S)
- S-tiocarbamatos (3), RSC(=O)NR2, nos cales o grupo R–O– é substituído por un grupo R–S–
Os O-tiocarbamatos poden isomerizarse a S-tiocarbamatos, por exemplo no rearranxo de Newman-Kwart.

Acción contaminante, persistencia e degradación[editar | editar a fonte]
A principal fonte de carbamatos son os insecticidas. A maioría dos carbamatos teñen unha toxicidade baixa pola reversibilidade da súa reacción coa acetilcolinesterase e a súa rápida degradación. As abellas son unha excepción, xa que son moi sensibles á presenza de carbamatos. Poden bioacumularse en peixes, se a súa metabolización é lenta, a pesar de seren inestables na auga debido á súa degradación por medio de hidrólise. A súa toxicidade é baixa en mamíferos. A maior parte dos seus metabolitos son menos tóxicos e son biodegradados rapidamente.[5]
A súa baixa presión de vapor fai que se encontren principalmente absorbidos no solo ou na auga. Poden ser metabolizados polos microorganismos do solo por hidrólise ou oxidación. A rápida adaptación dos microorganismos á degradación dos carbamatos pode afectar á súa persistencia. Os carbamatos absorben luz ultravioleta e os presentes en augas superficiais poden ser degradados pola radiación solar. A hidrólise dos carbamatos produce liberación do alcohol e formación de ácido carbámico, este ácido carbámico descomponse posteriormente na amina e dióxido de carbono.
Notas[editar | editar a fonte]
- ↑ Bartoschek, S.; Vorholt, J. A.; Thauer, R. K.; Geierstanger, B. H. and Griesinger, C., "N-Carboxymethanofuran (carbamate) formation from methanofuran and CO2 in methanogenic archaea : Thermodynamics and kinetics of the spontaneous reaction", Eur. J. Biochem., 2001, 267, 3130-3138. doi 10.1046/j.1432-1327.2000.01331.x
- ↑ Robert L. Metcalf “Insect Control” in Ullmann’s Encyclopedia of Industrial Chemistry” Wiley-VCH, Weinheim, 2002. doi 10.1002/14356007.a14_263
- ↑ Badreshia, S (2002). "Iodopropynyl butylcarbamate". American Journal of Contact Dermatitis 13 (2): 77–79. ISSN 1046-199X. doi:10.1053/ajcd.2002.30728.
- ↑ Holland JR, Hosley H, Scharlau C, Carbone PP, Frei E 3rd, Brindley CO, Hall TC, Shnider BI, Gold GL, Lasagna L, Owens AH Jr, Miller SP (1 de marzo de 1966). "A controlled trial of urethane treatment in multiple myeloma". Blood 27 (3): 328–42. ISSN 0006-4971. PMID 5933438. Arquivado dende o orixinal (free fulltext) o 28 de marzo de 2007. Consultado o 22 de maio de 2012.
- ↑ [1], CARBAMATE PESTICIDES: A GENERAL INTRODUCTION (EHC 64, 1986).
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Metil carbamato (uretano)
