Síntese de ácidos graxos
A síntese de ácidos graxos é un proceso metabólico que consiste na formación de ácidos graxos a partir de precursores como o acetil-CoA e malonil-CoA en reaccións catalizadas por encimas denominados ácido graxo sintases. Esta síntese é unha importante parte da lipoxénese, a cal, xunto coa glicólise, orixina graxas a partir do azucre sanguíneo nos seres vivos.
Ácidos graxos de cadea liñal (non ramificada)[editar | editar a fonte]
Os ácidos graxos de cadea liñal poden ser de dous tipos: saturados e insaturados.
Ácidos graxos saturados de cadea liñal[editar | editar a fonte]

De xeito similar á β-oxidación, os ácidos graxos de cadea liñal sintetízanse por medio das seis reaccións que se repiten que se mostran máis abaixo, ata que se orixina o ácido palmítico de 16 carbonos.[1]
Os diagramas presentados mostran como se sintetizan os ácidos graxos en microorganismos e indican os encimas que se encontran en Escherichia coli.[1] Estas reaccións catalízaas o encima ácido graxo sintase II (FASII), o cal en xeral contén múltiples encimas que actúan como un complexo multiencimático. A ácido graxo sintase II está presente en procariotas, plantas, fungos, e parasitos, e nas mitocondrias.[2]
Nos animais, e nos lévedos e algúns outros fungos, estas mesmas reaccións realízaas a ácido graxo sintase I (FASI), unha proteína dimérica grande que presenta todas as actividades encimáticas que cómpren para producir un ácido graxo. A FASI é menos eficiente ca a FASII; porén, permite a formación de máis moléculas, incluíndo os ácidos graxos de cadea de “tamaño medio” por medio dunha terminación temperá da cadea.[2]
Unha vez que se formou un ácido graxo de 16 carbonos saturado (16:0), pode sufrir diversas modificacións, en particular pola ácido graxo sintase III (FASIII), a cal utiliza dúas moléculas de carbono para alongar ácidos graxos xa formados.[2]
| Paso | Encima | Reacción | Descrición |
|---|---|---|---|
| (a) | Acetil CoA:ACP transacilase | Activa o acetil CoA por reacción co malonil-ACP | |
| (b) | Malonil CoA:ACP transacilase | Activa o malonil-CoA por reacción co acetil-ACP | |
| (c) | 3-cetoacil-ACP sintetase | 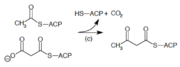 |
Reacciona cebando o acetil-ACP con malonil-ACP extensor da cadea. |
| (d) | 3-cetoacil-ACP redutase | Reduce o carbono 3 cetona a un grupo hidroxilo | |
| (e) | 3-hidroxiacil ACP deshidrase | Retira auga | |
| (f) | Enoíl-ACP redutase | Reduce o dobre enlace C3-C4. |
Abreviaturas: ACP = Proteína portadora de acilos, CoA = Coencima A, NADP = Nicotinamida adenina dinucleótido fosfato.
Regulación
O acetil-CoA dá lugar a malonil-CoA por acción da acetil-CoA carboxilase, e o malonil-CoA está destinado a entrar na vía de síntese de ácidos graxos. A acetil-CoA carboxilase é o punto de regulación na síntese de ácidos graxos saturados de cadea liñal, e está sometida a regulación alostérica ou por fosforilación. A regulación por fosforilación ten lugar principalmente nos animais, e a regulación alostérica na maioría dos organismos. O control alostérico é unha inhibición por retroalimentación polo palmitoíl-CoA e a activación polo citrato. Cando hai niveis altos de palmitoíl-CoA, que é o produto final da síntese dos ácidos graxos saturados, este inactiva alostericamente a acetil-CoA carboxilase para impedir a formación de ácidos graxos nas células. O citrato actúa activando a acetil-CoA carboxilase, porque os altos niveis de citrato indican que hai acetil-CoA dabondo para alimentar o ciclo de Krebs e producir enerxía.[3]
Síntese de novo en humanos
Nos humanos, os ácidos graxos fórmanse predominantemente no fígado e nas glándulas mamarias lactantes, e, en menor medida, no tecido adiposo. A maioría do acetil-CoA fórmase a partir do piruvato pola acción da piruvato deshidroxenase na mitocondria. O acetil-CoA producido na mitocondria condénsase con oxalacetato pola acción da citrato sintase para formar citrato, o cal é despois transportado ao citosol e degradado para render acetil-CoA e oxalacetato en reacción catalizada pola ATP citrato liase. O oxalacetato é reducido no citosol a malato pola malato deshidroxenase citoplasmática, e o malato é transportado de volta ás mitocondrias para participar no ciclo do ácido cítrico.[4]
Desaturación (formación de dobres enlaces)[editar | editar a fonte]
A desaturación dos ácidos graxos implica un proceso que require osíxeno molecular (O2), NADH, e citocromo b5. A reacción, que ten lugar no retículo endoplasmático, causa a oxidación dos ácidos graxos e do NADH. As reaccións de desaturación máis comúns crean un dobre enlace entre os carbonos 9 e 10 (como na conversión do ácido palmítico en ácido palmitoleico e a conversión do ácido esteárico en ácido oleico. Nos humanos poden desaturarse outras posicións como as dos carbonos 4, 5, e 6, pola acción de Δ4-, Δ5-, e Δ6-desaturases, respectivamente.
Os ácidos graxos insaturados son compoñentes esenciais das membranas das células eucarióticas e procarióticas. Estes ácidos graxos funcionan principalmente mantendo a fluidez da membrana.[5] Tamén foron asociados coa sinalización celular noutros procesos como a diferenciación celular e a replicación do ADN.[5] Hai dúas vías que utilizan os organismos para a desaturación: aeróbica e anaeróbica.
Desaturación anaeróbica[editar | editar a fonte]
Moitas bacterias utilizan a vía anaeróbica para sintetizar ácidos graxos insaturados. Esta vía non utiliza osíxeno e depende de encimas para inserir o dobre enlace antes do alongamento utilizando a maquinaria de síntese dos ácidos graxos normais. En Escherichia coli, esta vía coñécese ben.

- A FabA é unha β-hidroxidecanoíl-ACP deshidrase. É específica para o intermediato de 10 carbonos da síntese de ácidos graxos saturados chamado β-hidroxidecanoíl-ACP.
- A FabA cataliza a deshidratación de β-hidroxidecanoíl-ACP, causando a liberación da auga e a inserción do dobre enlace entre C7 e C8 contando desde o extremo metilo. Isto orixina o intermediato trans-2-decenoíl.
- O intermediato trans-2-decenoíl ou ben pode ser enviado á vía de síntese dos ácidos graxos saturados normais pola FabB, onde o dobre enlace se hidrolizará e o produto final é un ácido graxo saturado, ou ben a FabA cataliza a isomerización no intermediato cis-3-decenoíl.
- A FabB é unha β-cetoacil-ACP sintase que alonga e canaliza intermediatos á vía principal de síntese de ácidos graxos. Cando a FabB reacciona co intermediato cis-decenoíl, o produto final despois do alongamento da cadea será un ácido graxo insaturado.[6]
- Os dous principais ácidos graxos insaturados que se producen son o palmitoleoíl-ACP (16:1ω7) e o cis-vaccenoíl-ACP (18:1ω7).[7]
A maioría das bacterias que sofren a desaturación anaeróbica conteñen homólogos da FabA e FabB.[8] Os clostridios son a principal excepción; posúen un novo encima, aínda non identificado, que cataliza a formación de dobres enlaces cis.[7]
Regulación
Esta vía ten unha regulación transcricional levada a cabo pola FadR e FabR. A que máis foi estudada é a proteína FadR, á que se lle atribuíron características bifuncionais. Actúa como un activador da transcrición de fabA e fabB e como represor do regulón da β-oxidación. Polo contrario, a FabR actúa como un represor para a transcrición de fabA e fabB.[6]
Desaturación aeróbica[editar | editar a fonte]

A desaturación aeróbica é a vía máis difundida entre os seres vivos para a síntese de ácidos graxos insaturados. Utilízase en todos os eucariotas e algúns procariotas. Esta vía utiliza desaturases para sintetizar ácidos graxos insaturados a partir de substratos que son ácidos graxos de cadea de lonxitude completa.[9] Todas as desaturases requiren osíxeno e consomen NADH (a pesar de que a desaturación é un proceso oxidativo). As desaturases son específicas para o dobre enlace concreto que introducen no substrato. En Bacillus subtilis, a desaturase, Δ5-Des, é específica para inducir un dobre enlace cis na posición Δ5.[5][9] Saccharomyces cerevisiae posúe unha desaturase chamada Ole1p, que induce a formación dun dobre enlace cis en Δ9.[5]
Regulación
En B. subtilis, esta vía está regulada por un sistema de dous compoñentes: DesK e DesR. A DesK é unha quinase asociada a membranas e a DesR é un regulador transcricional do xene des.[5][9] A regulación responde á temperatura, e cando baixa a temperatura a expresión deste xene está aumentada. Os ácidos graxos insaturados incrementan a fluidez da membrana e estabilizana a baixas temperaturas. A DesK é unha proteína sensora que, cando descende a temperatura, se autofosforila. A DesK-P transfire este grupo fosforilo á DesR. Despois, dúas proteínas DesR-P dimerízanse e únense aos promotores do ADN do xene des e recrutan a ARN polimerase para que empece a transcrición.[5][9]
Pseudomonas aeruginosa
En xeral, tanto a síntese de ácidos graxos insaturados aeróbica coma a anaeróbica non teñen lugar no mesmo sistema, porén Pseudomonas aeruginosa e Vibrio ABE-1 son excepcións.[10][11][12] P. aeruginosa presenta principalmente desaturación anaeróbica, pero tamén ten dúas vías aeróbicas. Unha vía utiliza unha Δ9 desaturase (DesA) que cataliza a formación de dobres enlaces en lípidos de membrana. A outra vía utiliza dúas proteínas, DesC e DesB, que xuntas actúan como unha Δ9 desaturase, a cal insire un dobre enlace nunha molécula de ácido graxo saturado-CoA. Esta segunda vía está regulada pola proteína represora DesT. A DesT é tamén un represor da expresión de fabAB para a desaturación anaeróbica cando está en presenza de ácidos graxos insaturados exóxenos. Isto funciona para coordinar a expresión das dúas vías nese organismo.[11][13]
Ácidos graxos de cadea ramificada[editar | editar a fonte]
Os ácidos graxos de cadea ramificada son normalmente saturados e divídense en dúas familias: a serie iso e a serie anteiso. As Actinomycetales conteñen mecanismos de síntese de ácidos graxos de cadea ramificada únicos, incluíndo o que forma o ácido tuberculostérico.
Sistema de síntese dos ácidos graxos de cadea ramificada[editar | editar a fonte]
Os sistemas de síntese de ácidos graxos de cadea ramificada utilizan α-cetoácidos como cebadores (primers). Este sistema é distinto da ácido graxo ramificado sintetase que utiliza como cebadores ésteres de acil-CoA de cadea curta.[14] Os cebadores α-cetoácidos derivan da transaminación e descarboxilación da valina, leucina, e isoleucina para formar 2-metilpropanil-CoA, 3-metilbutiril-CoA, e 2-metilbutiril-CoA, respectivamente.[15] Os cebadores 2-metilpropanil-CoA derivados da valina son despois alongados para producir ácidos graxos da serie iso de númeo par de carbonos, como o ácido 14-metil-pentadecanoico (ácido isopalmítico), e os cabadores 3-metilbutiril-CoA formados a partir da leucina poden utilizarse para formar ácidos graxos da serie iso de número impar de carbonos, como o ácido 13-metil-tetradecanoico. Os cebadores 2-metilbutiril-CoA da isoleucina alónganse para formar ácidos graxos da serie anteiso que conteñen un número impar de átomos de carbono, como o ácido 12-metil tetradecanoico.[16] A descarboxilación dos precursores dos cebadores ten lugar por medio do encima α-cetoácido de cadea ramificada descarboxilase (BCKA). A elongación do ácido graxo segue a mesma vía biosintética en Escherichia coli utilizada para producir ácidos graxos de cadea recta (non ramificada) no que se utiliza o malonil-CoA para alongar a cadea.[17] Os principais produtos finais son ácidos graxos de 12-17 carbonos de cadea ramificada e a súa composición tende a ser uniforme e característica de moitas especies de bacterias.[16]
 |
 |
 |
A BCKA descarboxilase e as actividades relativas dos substratos α-cetoácidos
O encima BCKA descarboxilase está composto por dúas subunidades distintas (A e B) que forman unha estrutura tetramérica (A2B2) e é esencial para a síntese de ácidos graxos de cadea ramificada. É responsable da descarboxilación dos α-cetoácidos formados pola transaminación da valina, leucina, e isoleucina e produce os cebadores utilizados para a síntese dos ácidos graxos de cadea ramificada. A actividade deste encima é moito maior con substratos α-cetoácidos de cadea ramificada do que con substratos de cadea recta (non ramificada), e en especies de Bacillus a súa especificidade é máxima para a o ácido α-ceto-β-metilvalérico derivado da isoleucina, seguido do α-cetoisocaproato e α-cetoisovalerato.[16][17] A alta afinidade do encima para os α-cetoácidos de cadea ramificada permítelle funcionar como o sistema doante de cebadores para a síntese dos ácidos graxos de cadea ramificada.[17]
| Substrato | Actividade da BCKA | CO2 producido (nmol/min mg) | Km (μM) | Vmax (nmol/min mg) |
|---|---|---|---|---|
| L-α-ceto-β-metil-valerato | 100% | 19,7 | <1 | 17,8 |
| α-cetoisovalerato | 63% | 12,4 | <1 | 13,3 |
| α-cetoisocaproato | 38% | 7,4 | <1 | 5,6 |
| Piruvato | 25% | 4,9 | 51,1 | 15,2 |
Factores que afectan á lonxitude da cadea e patrón de distribución
Os cebadores α-cetoácidos utilízanse para producir ácidos graxos de cadea ramificada que, en xeral, teñen entre 12 e 17 carbonos de lonxitude. As proporcións destes ácidos graxos de cadea ramificada tenden a ser uniformes e consistentes nunha determinada especie de bacteria pero poden ser alteradas debido aos cambios na concentración de malonil-CoA, temperatura, ou presenza de factores estables á calor (HSF).[16] Todos estes factores poden afectar á lonxitude da cadea, e os factores estables á calor alteran a especificidade da BCKA descarboxilase para un determinado substrato α-cetoácido, cambiando desta maneira a proporción de ácidos graxos de cadea ramificada producidos.[16] Un incremento da concentración de malonil-CoA orixina unha gran proporción de produción de ácidos graxos de 17 carbonos, ata chegar á concentrción óptima (≈20μM) de malonil-CoA. A baixada das temperaturas tende tamén a cambiar a distribución dos ácidos graxos producidos aumentando lixeiramente os ácidos graxos C17 en especies de Bacillus.[14][16]
Ácido graxo de cadea ramificada sintase[editar | editar a fonte]
Este sistema funciona de xeito similar ao sistema de síntese de ácidos graxos de cadea ramificada, porén utiliza ácidos carboxílicos de cadea curta como cebadores en lugar de α-cetoácidos. En xeral, este método utilízano as bacterias que non teñen a capacidade de utilizar o sistema de síntese de ácidos graxos de cadea ramificada usando cebadores α-ceto. Os cebadores de cadea curta inclúen o isovalerato, isobutirato, e 2-metil butirato. En xeral, os ácidos que se necesitan como cebadores tómanse do ambiente, como se observa, por exemplo, nas bacterias do rume.[18]
A reacción global é: Isobutiril-CoA + 6 malonil-CoA + 12 NADPH + 12 H+ → Ácido isopalmítico + 6 CO2 12 NADP + 5 H2O + 7 CoA[14]
A diferenza entre a ácido graxo (de cadea recta) sintase e a ácido graxo de cadea ramificada sintase é a especificidade de substrato do encima que cataliza a reacción do acil-CoA ao acil-ACP.[14]
Ácidos graxos omega alicíclicos[editar | editar a fonte]
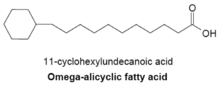
Os ácidos graxos omega alicíclicos conteñen un grupo propilo ou butirilo omega terminal cíclico e son algúns dos principais ácidos graxos de membrana que se atopan en varias especies de bacterias. Os compostos alicíclicos conteñen cadeas alifáticas cíclicas (non aromáticas), e os omega alicíclicos teñen estes ciclos no último carbono. A ácido graxo sintetase utilizada para producir ácidos graxos omega alicíclicos úsase tamén para producir ácidos graxos de cadea ramificada de membrana. Nas bacterias con membranas compostas principalmente por ácidos graxos omega alicíclicos, o fornecemento de ésteres ácidos carboxílicos cíclicos-CoA é moito maior ca o de cebadores de cadea ramificada.[14] A síntese de cebadores cíclicos non se comprende ben aínda pero suxeriuse que o mecanismo implica a conversión de azucres en ácido siquímico, o cal se converte despois nos ésteres ácido ciclohexilcarboxílico-CoA que serven como cebadores para a síntese de ácidos graxos omega alicíclicos.[18]
Síntese do ácido tuberculoesteárico[editar | editar a fonte]

O ácido tuberculoesteárico (ácido D-10-metilesteárico) é un ácido graxo saturado que producen os Mycobacterium spp. e dúas especies de Streptomyces. Fórmase a partir do precursor ácido oleico (un ácido graxo monoinsaturado).[19] Despois de que o ácido oleico se esterifica cun fosfolípido, a S-adenosilmetionina doa un grupo metilo ao dobre enlace do ácido oleico.[20] Esta reacción de metilación forma o intermediato 10-metileno-octadecanoial. A subseguinte redución do residuo, con NADPH como cofactor, orixina ácido 10-metilesteárico.[15]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Dijkstra, Albert J., R. J. Hamilton, and Wolf Hamm. "Fatty Acid Biosynthesis." Trans Fatty Acids. Oxford: Blackwell Pub., 2008. 12. Print.
- ↑ 2,0 2,1 2,2 "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis." Lipid Library - Lipid Chemistry, Biology, Technology and Analysis. Web. 30 Apr. 2011. <http://lipidlibrary.aocs.org/lipids/fa_sat/index.htm Arquivado 21 de xullo de 2011 en Wayback Machine.>.
- ↑ Diwan, Joyce J. "Fatty Acid Synthesis." Rensselaer Polytechnic Institute (RPI) :: Architecture, Business, Engineering, IT, Humanities, Science. Web. 30 Apr. 2011. <http://rpi.edu/dept/bcbp/molbiochem/MBWeb/mb2/part1/fasynthesis.htm Arquivado 07 de xuño de 2011 en Wayback Machine.>.
- ↑ Ferre, P.; F. Foufelle (2007). "SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective". Hormone Research 68 (2): 72–82. PMID 17344645. doi:10.1159/000100426. Consultado o 2010-08-30.
this process is outlined graphically in page 73
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Aguilar, Pablo S, and Diegode Mendoza. "Control of fatty acid desaturation: a mechanism conserved from bacteria to humans." Molecular microbiology 62.6 (2006):1507-14.
- ↑ 6,0 6,1 Feng, Youjun, and John ECronan. "Complex binding of the FabR repressor of bacterial unsaturated fatty acid biosynthesis to its cognate promoters." Molecular microbiology 80.1 (2011):195-218.
- ↑ 7,0 7,1 Zhu, Lei, et al. "Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis." BMC microbiology 9(2009):119.
- ↑ Wang, Haihong, and John ECronan. "Functional replacement of the FabA and FabB proteins of Escherichia coli fatty acid synthesis by Enterococcus faecalis FabZ and FabF homologues." Journal of biological chemistry 279.33 (2004):34489-95.
- ↑ 9,0 9,1 9,2 9,3 Mansilla, Mara C, and Diegode Mendoza. "The Bacillus subtilis desaturase: a model to understand phospholipid modification and temperature sensing." Archives of microbiology 183.4 (2005):229-35.
- ↑ Wada, M, N. Fukunaga, and S. Sasaki. "Mechanism of biosynthesis of unsaturated fatty acids in Pseudomonas sp. strain E-3, a psychrotrophic bacterium." Journal of bacteriology 171.8 (1989):4267-71.
- ↑ 11,0 11,1 Subramanian, Chitra, Charles ORock, and Yong-MeiZhang. "DesT coordinates the expression of anaerobic and aerobic pathways for unsaturated fatty acid biosynthesis in Pseudomonas aeruginosa." Journal of bacteriology 192.1 (2010):280-5.
- ↑ Morita, N, et al. "Both the anaerobic pathway and aerobic desaturation are involved in the synthesis of unsaturated fatty acids in Vibrio sp. strain ABE-1." FEBS letters 297.1-2 (1992):9-12.
- ↑ Zhu, Kun, et al. "Two aerobic pathways for the formation of unsaturated fatty acids in Pseudomonas aeruginosa." Molecular microbiology 60.2 (2006):260-73.
- ↑ 14,0 14,1 14,2 14,3 14,4 Kaneda, Toshi. "Iso- and Anteiso-Fatty Acids in Bacteria: Biosynthesis, Function, and Taxonomic Significance." Microbiological Reviews 55.2 (1991): 288-302
- ↑ 15,0 15,1 "Branched-chain Fatty Acids, Phytanic Acid, Tuberculostearic Acid Iso/anteiso- Fatty Acids." Lipid Library - Lipid Chemistry, Biology, Technology and Analysis. Web. 01 May 2011. http://lipidlibrary.aocs.org/lipids/fa_branc/index.htm Arquivado 12 de xaneiro de 2010 en Wayback Machine..
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 Naik, Devaray N., and Toshi Kaneda. "Biosynthesis of Branched Long-chain Fatty Acids by Species of Bacillus: Relative Activity of Three α-keto Acid Substrates and Factors Affecting Chain Length." Can. J. Microbiol. 20 (1974): 1701-708.
- ↑ 17,0 17,1 17,2 Oku, Hirosuke, and Toshi Kaneda. "Biosynthesis of Branched-chain Fatty Acids in Bacillis Subtilis." The Journal of Biological Chemistry 263.34 (1988): 18386-8396.
- ↑ 18,0 18,1 Christie, William W. "Fatty Acids: Natural Alicyclic Structures, Occurrence, and Biochemistry." The AOCS Lipid Library. 5 Apr. 2011. Web. 24 Apr. 2011. <http://lipidlibrary.aocs.org/lipids/fa_cycl/file.pdf Arquivado 21 de xullo de 2011 en Wayback Machine.>.
- ↑ Ratledge, Colin, and John Stanford. The Biology of the Mycobacteria. London: Academic, 1982. Print.
- ↑ Kubica, George P., and Lawrence G. Wayne. The Mycobacteria: a Sourcebook. New York: Dekker, 1984. Print.




