Acetilación

A acetilación (que na nomenclatura da IUPAC se denomina etanoilación) é unha reacción que introduce un grupo funcional acetil nun composto químico. (A reacción contraria é a desacetilación, que é a retirada dun grupo acetil dun composto).
A acetilación refírese ao proceso de introducir un grupo acetil (o que ten como resultado a formación dun grupo acetoxi) nun composto, concretamente a substitución dun átomo de hidróxeno activo por un grupo acetil. Unha reacción que implique substituír un átomo de hidróxeno pertencente a un grupo hidroxilo por un grupo acetil (CH3-CO) rende un éster específico, un acetato. O anhídrido acético utilízase comumente como axente acetilante que reacciona con grupos hidroxilo libres. Por exemplo, utilízase na síntese de aspirina e heroína.
Acetilación de proteínas[editar | editar a fonte]
A acetilación é unha importante modificación das proteínas nas células; e os estudos de proteómica identificaron miles de proteínas de mamíferos acetiladas.[1][2][3] A modificación de proteínas consiste nunha modificación cotraducional e postraducional. A modificación cotraducional é o proceso de alterar covalentemente un ou máis aminoácidos nunha proteína ao mesmo tempo que esta se está a traducir nos polirribosomas a partir do seu ARN mensaxeiro;[4] e a modificación postraducional é posterior e inclúe a fosforilación, glicosilación, ubiquitinación, nitrosilación, metilación, acetilación, lipidación e proteólise, despois do cal a proteína é un produto maduro.[5] Exemplos de acetilación cotraducional ou postraducional de proteínas danse nas histonas, p53, e tubulinas. Entre as proteínas acetiladas, as proteínas da cromatina e os encimas metabólicos son as máis representadas, o que indica que a acetilación ten un impacto considerable sobre a expresión xénica e o metabolismo. En bacterias, por exemplo, o 90% das proteínas que interveñen no metabolismo central de Salmonella enterica están acetiladas.[6]
Acetilación N-terminal[editar | editar a fonte]

A acetilación N-terminal é unha das modificacións covalentes cotraducionais de proteínas máis común en eucariotas, e é crucial para a regulación e funcionamento de diferentes proteinas. A acetilación N-terminal xoga un importante papel na síntese estabilidade e localización de proteínas. Arredor do 85% de todas as proteínas humanas e o 68% das de lévedos están acetiladas no seu Nα-terminal.[7] Varias proteínas de procariotas e arqueas son tamén modificadas por acetilación N-terminal.
A acetilación N-terminal está catalizada por un conxunto de complexos encimáticos, as acetiltransferases N-terminais (NATs). As NATs transfiren un grupo acetil desde o acetil coencima A (Ac-CoA) ao grupo α-amino do primeiro residuo de aminoácido da proteína. Diferentes NATs son responsables da acetilación dos N-terminais de proteínas nacentes.[8]
Acetiltransferases N-terminais[editar | editar a fonte]
Ata agora foron atopadas en humanos seis acetiltransferases N-terminais ou NATs, que son: NatA, NatB, NatC, NatD, NatE e NatF. Cada un destes complexos encimáticos é específico para diferentes aminoácidos ou secuencias de aminoácidos, o que se mostra na seguinte táboa.
Táboa 1. Composición e especificidade de substrato das NATs.
| NAT | Subunidades (subunidades catalíticas en negra) | Substratos |
|---|---|---|
| NatA | Naa10 (Ard1) Naa15 (Nat1) | Ser-, Ala-, Gly-, Thr-, Val-, Cys- N-terminais |
| NatB | Naa20 (Nat3) Naa25 (Mdm20) | Met-Glu-, Met-Asp-, Met-Asn-, Met-Gln- N-terminais |
| NatC | Naa30 (Mak3) Naa35 (Mak10) Naa40 (Nat5) | Met-Leu-, Met-Ile-, Met-Trp-, Met-Phe- N-terminais |
| NatD | Naa40 (Nat4) | Ser-Gly-Gly-, Ser-Gly-Arg- N-terminais |
| NatE | Naa50 (Nat5) Naa10 (Ard1) Naa15 (Nat1) | Met-Leu-, Met-Ala-, Met-Lys-, Met-Met- N-terminais |
| NatF | Naa60 | Met-Lys-, Met-Leu-, Met-Ile-, Met-Trp-, Met-Phe- N-terminais |
NatA[editar | editar a fonte]

NatA está composta por dúas subunidades, a subunidade catalítica Naa10 e a subunidade auxiliar Naa15. As subunidades de NatA son máis complexas nos eucariotas superiores que nos inferiores. Ademais dos xenes NAA10 e NAA15, os xenes específicos de mamíferos NAA11 e NAA16, orixinan produtos xénicos funcionais, que forman diferentes complexos activos NatA. Hai catro posibles dímeros de subunidades auxiliar-cataítica de NatA que están formados por estas catro proteínas. Porén, a NatA máis abondosa é Naa10/Naa15.[10]
NatA acetila a Ser, Ala, Gly, Thr, Val e Cys N-terminais despois de que é retirada a metionina iniciadora polas metionina amino-peptidases. Estes aminoácidos exprésanse máis frecuentemente no extremo N-terminal de proteínas en eucariotas, polo que NatA é a principal NAT en correspondencia co número total dos seus substratos potenciais.[11]
Na acetilación N-terminal por NatA están implicadas varias proteínas interaccionantes. A proteína K que interacciona coa huntingtina (HYPK) interacciona con hNatA no ribosoma e afecta a acetilación N-terminal dun subconxunto de substratos de NatA. As subunidades hNaa10 e hNaa15 incrementan a tendencia de agregación da huntingtina se o nivel de HYPK diminúe. O factor inducible da hipoxia (HIF)-1α interacciona tamén con hNaa10 para inhibir a activación mediada por hNaa10 da actividade transcricional da β-catenina.[12]
NatB[editar | editar a fonte]
Os complexos NatB están compostos pola subuinidade catalítica Naa20p e a subunidade auxiliar Naa25p, que se encontran ambas en lévedos e humanos. En lévedos, todas as subunidades NatB están asociadas a ribosomas; pero en humanos, as subunidades NatB poden estar tanto asociadas a ribosomas coma ser formas non ribosómicas. A NatB acetila a metionina N-terminal dos substratos que empezan con Met-Glu-, Met-Asp-, Met-Asn- ou Met-Gln- N terminais.
NatC[editar | editar a fonte]
O complexo NatC consta dunha subunidade catalítica Naa30p e dúas subunidades auxilaires Naa35p e Naa38p. As tres subunidades encóntranse no ribosoma nos lévedos, pero tamén se encontran en formas de NAT non ribosómicas como Nat2. O complexo NatC acetila a metionina do extremo N-terminal de substratos Met-Leu-, Met-Ile-, Met-Trp- ou Met-Phe N-terminais.
NatD[editar | editar a fonte]
NatD só está formada pola unidade catalítica Naa40p e Naa40p e é unha forma conceptualmente diferente das outras NATs. En primeiro lugar, só se identificaron dous substratos seus, as histonas H2A e H4, en lévedos e humanos. En segundo lugar, a especificidade de substrato de Naa40p encóntrase nos primeiros 30-50 residuos, o que é unha secuencia bastante maior que a da especificidade de substrato doutras NATs. A acetilación de histonas polas NatD está parcialmente asociada cos ribosomas e os substratos aminoácidos son residuos moi N-terminais, o que fai que sexa diferente das lisina N-acetiltransferases (KATs).[13]
NatE[editar | editar a fonte]
O complexo NatE consta dunha subunidade Naa50p e dúas NatA (Naa10p e Naa15p). O N-terminal dos substratos de Naa50p é diferente do dos substratos acetilados pola actividade NatA de Naa10p.[14]
NatF[editar | editar a fonte]
NatF é unha nova NAT identificada en 2011, que está composta polo encima Naa60p. Ata gora, NatF só se atopou en eucariotas superiores, pero non en inferiores. Comparada coa dos lévedos, NatF contribúe á grande abundancia de acetilacións N-terminais en humanos. O complexo NatF acetila a metionina N-terminal dos substratos Met-Lys-, Met-Leu-, Met-Ile-, Met-Trp- e Met-Phe N-terminais, que está parcialmente solapada con NatC e NatE.[7]
Función de acetilación N-terminal[editar | editar a fonte]
Estabilidade das proteínas[editar | editar a fonte]
A acetilación N-terminal de proteínas pode afectar á estabilidade das proteínas pero os resultados e o mecanismo non está moi claro polo momento.[15] Críase que a acetilación N-terminal protexía as proteínas da degradación, xa que se supoñía que a Nα-acetilación N-terminal bloqueaba a ubiquitinación N-terminal e a subseguinte degradación de proteínas.[16] Non obstante, varios estudos atoparon que as proteínas con acetilación N-terminal teñen unha taxa de degradación similar á das proteínas con sinais de degradación específicos e sen N-terminais bloqueados.[17]
Localización de proteínas[editar | editar a fonte]
A acetilación N-terminal pode dirixir a localización que van ter as proteínas. A Arl3p contén unha Phe (en Arl3p de lévedos), ou unha Tyr (en Arl3p humana), que podería ser acetilada por NatC. Arl3p é unha das GTPases de tipo Arf (Arl), que é crucial para a organización do tráfico de proteínas nas membranas do aparato de Golgi.[18] Para quedar etiquetada con destino á membrana do Golgi élle necesario o seu grupo Nα-acetil e ademais a interacción coa proteína residente na membrana do Golgi Sys1p. Se a Phe ou Tyr son substituídas por unha Ala no N-terminal de Arl3p, esta xa non pode localizarse na membrana do aparato de Golgi, o que indica que Arl3p necesita os seus residuos N-terminais naturais, que deben ser acetilados para unha correcta localización.[19]
Metabolismo e apoptose[editar | editar a fonte]
En experimentos de knockdown de proteínas demostrouse que a acetilación N-terminal de proteínas está tamén relacionada coa regulación do ciclo celular e a apoptose. O knockdown dos complexos NatA ou NatC causa a indución da apoptose dependente de p53, o cal pode indicar que as proteínas antiapoptóticas son menos ou nada funcionais debido á redución da acetilación N-terminal das proteínas.[20] Pero, en contraste co anterior, a caspase-2, que é acetilada por NatA, pode interaccionar coa proteína homóloga Ich-1/Ced-3 asociada coa proteína adaptadora RIP; a ich-1/Ced-3 ten un dominio de morte (RAIDD). Isto podería activar a caspase-2 e inducir a apoptose celular. O acetil-CoA serve como unha molécula sinalizadora que acopla a sensibilidade apoptótica ao metabolismo ao regular a N-alfa-acetilación de proteínas.[21]
Síntese de proteínas[editar | editar a fonte]
As proteínas ribosómicas xogan un importante papel na síntese de proteínas. A acetilación N-terminal das proteínas ribosómicas pode ter un efecto sobre a síntese de proteínas. Observouse un descenso do 27% e 23% na velocidade de síntese proteica en cepas de lévedos con delecións en NatA e NatB. Observouse unha redución na fidelidade de tradución na cepa con deleción en NatA e atopouse un defecto no ribosoma na cepa con deleción en NatB.[22]
Cancro[editar | editar a fonte]
Suxeriuse que as NATs actúan tanto como oncoproteínas coma como supresores de tumores en cancros humanos, e a expresión de NAT pode estar incrementada ou diminuída en células cancerosas. A expresión ectópica de hNaa10p incrementa a proliferación celular e a regulación á alza de xenes implicados na supervivencia e proliferación celular e o metabolismo. A sobreexpresión de hNaa10p observouse no cancro de vexiga, de mama e de cérvix uterino.[23] Pero un alto nivel de expresión de hNaa10p podería tamèn suprimir o crecemento de tumores, e un nivel reducido da expresión de hNaa10p está asociado cun peor prognóstico da doenza, tumores meirandes e máis metástases nos ganglios linfáticos.
Táboa 2. Expresión das subunidades de NatA en varios tecidos cancerosos[24]
| Subunidades de Nat | Tecido canceroso | Patrón de expresión |
|---|---|---|
| hNaa10 | cancro de pulmón, cancro de mama, cancro colorrectal, carcinoma hepatocelular | alta en tumores |
| hNaa10 | cancro de pulmón, cancro de mama, cancro de páncreas, cancro de ovario | perda de heterocigose en tumores |
| hNaa10 | cancro de mama, cancro gástrico, cancro de pulmón | alta en tumores primarios, pero baixa con metástases en ganglios linfáticos |
| hNaa10 | cancro de pulmón de células non pequenas | baixa en tumores |
| hNaa15 | carcinoma tiroide papilar, cancro gástrico | alta en tumores |
| hNaa15 | neuroblastoma | alto en tumores en estado avanzado |
| hNaa11 | carcinoma hepatocelular | perda de heterocigose en tumores |
Acetilación e desacetilación da lisina[editar | editar a fonte]

As proteínas son acetiladas tipicamente en residuos de lisina e esta reacción depende do acetil coencima A como grupo doante de acetís. na acetilación e desacetilación de histonas, as proteínas histonas son acetiladas e desacetiladas en residuos de lisina na súa cola N-terminal como parte da regulación xénica. Normalmente, estas reaccións son catalizadas por encimas con actividade de histona acetiltransferase (HAT) ou histona desacetilase (HDAC), aínda que as HATs e HDACs tamén poden modificar o estado de acetilación de proteína non histonas.[25]
a regulación de factores de transcrición, proteínas efectoras, chaperonas moleculares, e proteínas do citoesqueleto por acetilación e desacetilación é un mecanismo regulador postraducional significativo.[26] Estes mecanismos reguladores son análogos á fosforilación e desfosforilación pola acción de quinases e fosfatases. O estado de acetilación dunha proteína non só pode modificar a súa actividade senón que se propuxo recentemente que esta modificación postraducional pode tamén contribuír xunto coa fosforilación, metilación, ubiquitinación, sumoilación, e outros procesos ao control dinámico da sinalización celular.[27] A regulación da proteína tubulina é un exemplo disto en neuronas e astroglía de rato.[28][29] Unha tubulina acetiltransferase localizada no axonema, acetila a subunidade α-tubulina nun microtúbulo ensamblado. Unha vez desensamblado, esta acetilación é retirada por outra desacetilase específica no citosol celular. Así, os micrtúbulos do axonema, que teñen unha vida media longa, levan unha "firma de acetilación", que está ausente nos micrtúbulos citosólicos que teñen unha vida media máis curta.
O descubrimento da acetilación de histonas (e desacetilación) puxo en evidencia a súa importancia na regulación transcricional no campo da epixenética. Porén, as histonas non son as únicas proteínas que son moi reguladas por acetilación postranscricional. Nos seguintes exemplos, escolléronse algunhas proteínas que son importantes en bioloxía que regulan a importante transdución de sinais en bioloxía por acetilación de proteínas. Ademais, a regulación da acetilación nesas proteínas tamén está relacionada con doenzas humanas e ten un potencial para o desenvolvemento de terapias.
p53[editar | editar a fonte]
A proteína p53 é un supresor de tumores que xoga un importante papel na transdución de sinais nas células, especialmente para manter a estabilidade do xenoma ao impedir as mutacións, polo que tamén se lle coñece como “o gardián do xenoma". Ademais, tamén regula o ciclo celular e impide o crecemento celular ao activar a p21, un regulador do ciclo celular. Cando hai danos no ADN graves, iníciase a morte celular programada. O funcionamento de p53 está regulado negativamente pola oncoproteína Mdm2. Os estudos realizados suxiren que Mdm2 forma un complexo con p53 e impide que este se una a a xenes que responden a p53 especificamente.[30][31]
Acetilación de p53[editar | editar a fonte]

A acetilación de p53 é indispensable para a súa activación. O nivel de acetilación de p53 increméntase significativamente cando a célula está sufrindo un estrés. Hai tres principais sitios de acetilación en p53: K164, K120 e o C-terminal.[32] Se só non funciona un dos sitios de acetilación, aínda se pode producir a activación de p21, pero se están bloqueados os tres sitios de acetilación, pérdese por completo a activación de p21 e a supresión do crecemento celular causado por p53. Ademais, a acetilación de p53 impide a súa unión ao represor Mdm2 sobre o ADN.[33] Ademais, tamén se suxeriu que a acetilación de p53 é esencial para as súas funcións proapoptóticas independentes da transcrición.[34]
Implicacións na terapia do cancro[editar | editar a fonte]
Como a principal función de p53 é a supresión de tumores, a idea de activar de p53 é unha estratexia interesante para o tratamento do cancro. Nutlin-3[35] é unha pequena molécula deseñada para dirixirse contra a interacción de p53 e Mdm2, o que mantén p53 sen desactivar.[36] Nas células cancerosas tratadas con Nutilin-3a, observouse a acetilación da Lys no C-terminal de p53.[37][38]
Microtúbulos[editar | editar a fonte]

A estrutura dos microtúbulos é a dun cilindro oco longo ensamblado dinamicamente a partír de dímeros de α/β-tubulina. Xogan un papel esencial no mantemento da estrutura da célula e de procesos celulares, como por exemplo, o movemento de orgánulos.[39] Ademais, os microtúbulos son responsables de formar o fuso mitótico das células eucariotas para arrastrar os cromosomas na mitose.[40][41]
Acetilación da tubulina[editar | editar a fonte]
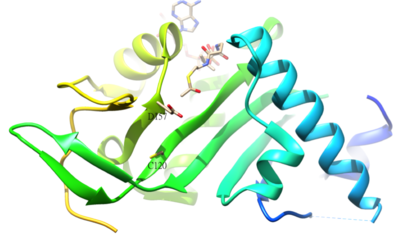
O residuo acetilado de α-tubulina é K40, e a súa acetilación está catalizada pola α-tubulina acetil-transferase (α-TAT) en humanos. A acetilación de K40 na α-tubulina é un sinal de que os microtúbulos son estables. Os residuos do sitio activo D157 e C120 da α-TAT1 son os responsables da catálise. Ademais, algunhas características estruturais únicas como a forquita β4-β5, o bucle C-terminal, e as rexións bucle α1-α2 son importantes para o recoñecemento molecular específico da α-tubulina.[42] A reacción inversa da acetilación está catalizada pola histona desacetilase 6.[43]
Implicacións na terapia do cancro[editar | editar a fonte]
Como os microtúbulos desempeñan un importante papel na división celular, especialmente na fase G2/M do ciclo celular, fixéronse intentos de impedir o funcionamento dos microtúbulos usando pequenas moléculas inhibidoras, o que foi utilizado con éxito en terapias clínicas contra o cancro.[44] Por exemplo, os alcaloides de Vinca e os taxanos únense selectivamente e inhiben os microtúbulos, o que fai que se deteña o ciclo celular.[45] A identificación da estrutura cristalina da α-tubulina acetil-transferase (α-TAT) tamén serviu para axudar ao descubrimento de pequenas moléculas que poderían modular a estabilidade ou a despolimerización da tubulina. Noutras palabras, tomando como diana a α-TAT, é posible impedir a acetilación da tubulina e isto orixina a desestabilización da tubulina, o cal é un mecanismo similar ao dos axentes que desestabilizan a tubulina.[42]
STAT3[editar | editar a fonte]
O transdutor de sinais e activador da transcrición 3 (STAT3, Signal transducer and activator of transcription 3) é un factor de transcrición que é fosforilado por quinases asociadas a un receptor; por exemplo, as tirosina quinases da familia Janus, e despois trasládase ao núcleo. STAT3 regula varios xenes en resposta a factores de crecemento e citocinas e xoga un importante papel no crecemento celular. Por tanto, STAT3 facilita a oncoxénese de diversos modos relacionados co crecemento celular. Por outra parte, tamén ten unha función como supresor de tumores.[46]
Acetilación de STAT3[editar | editar a fonte]

A acetilación da Lys685 de STAT3 é importante para a homodimerización de STAT3, que é esencial para a activación transcricional de oncoxenes. A acetilación de STAT3 é catalizada pola histona acetiltransferase p300, e revertida pola histona desacetilase de tipo I. A acetilación da lisina de STAT3 está tamén elevada en células cancerosas.[47]
Implicacións na terapia do cancro[editar | editar a fonte]
Como a acetilación de STAT3 é importante pola súa actividade oncoxénica e como o nivel do STAT3 acetilado é alto en células cancerosas, isto implica que unha estratexia prometedora é tomar como obxectivo o STAT3 acetilado en quimioprevención e quimioterapia. Esta estratexia está apoiada polo tratamento feito con resveratrol, que causa unha inhibición da acetilación de STAT3. En liñas celulares cancerosas parece que STAT3 regula a metilación de illas CpG.[48]
Acetilación da madeira[editar | editar a fonte]
Desde principios do século XX, investigouse a acetilación da madeira como un método para aumentar a duración da madeira en canto á súa resistencia contra os procesos de apodrecemento e o ataque de fungos. Entre outros beneficios secundarios están a mellora da estabilidae dimensional, da dureza das superficies, e a non diminución de propiedades mecánicas debido ao tratamento. As propiedades físicas de calquera material están determinadas pola súa estrutura química. A madeira contén unha abundancia de grupos químicos chamados “hidroxilos libres”. Os grupos hidroxilo libres adsorben e liberan auga segundo os cambios nas condicións climáticas ás que está exposta a madeira. Isto serve para explicar por que a madeira incha e encolle. Tamén se cre que a dixestión da madeira por encimas iníciase nos sitios con hidroxilos libres, o cal é unha das principais razóns polas cales a madeira tende a apodrecer.
A acetilación cambia os hidroxilos libres da madeira a grupos acetil. Isto prodúcese ao reaccionar a madeira con anhídrido acético, o cal procede do ácido acético. Cando os grupos hidroxilo libres son transformados en grupos acetil, a capacidade da madeira de absorber auga redúcese moito, facendo que a madeira se faga máis estable dimensionalmente e, como xa non é dixestible, é extemadamente duradeira. A madeira Accoya® é unha madeira acetilada comercial patentada.
Notas[editar | editar a fonte]
- ↑ Choudhary C, Kumar C, Gnad F, Nielsen ML, Rehman M, Walther TC, Olsen JV, Mann M (2009). "Lysine acetylation targets protein complexes and co-regulates major cellular functions". Science 325 (5942): 834–840. Bibcode:2009Sci...325..834C. PMID 19608861. doi:10.1126/science.1175371.
- ↑ Fritz KS, Galligan JJ, Hirschey MD, Verdin E, Petersen DR (2012). "Mitochondrial acetylome analysis in a mouse model of alcohol-induced liver injury utilizing SIRT3 knockout mice". J. Proteome Res. 11 (3): 1633–1643. PMC 3324946. PMID 22309199. doi:10.1021/pr2008384.
- ↑ Brook, Tom. "Protein Acetylation: Much More than Histone Acetylation". Cayman Chemical. Arquivado dende o orixinal o 28 de febreiro de 2014. Consultado o 29 de maio de 2015.
- ↑ Heal WP, Wickramasinghe SR, Bowyer PW, Holder AA, Smith DF, Leatherbarrow RJ, Tate EW (2008). "Site-specific N-terminal labelling of proteins in vitro and in vivo using N-myristoyl transferase and bioorthogonal ligation chemistry". Chem. Commun. (Camb.) (4): 480. PMID 18188474. doi:10.1039/b716115h.
- ↑ Robert K. Murray; et al. (2003). Harper's illustrated biochemistry (26th ed.). New York ; London: McGraw-Hill. ISBN 0-07-138901-6.
- ↑ Zhao S, Xu W, Jiang W, Yu W, Lin Y, Zhang T, Yao J, Zhou L, Zeng Y, Li H, Li Y, Shi J, An W, Hancock SM, He F, Qin L, Chin J, Yang P, Chen X, Lei Q, Xiong Y, Guan KL (2010). "Regulation of cellular metabolism by protein lysine acetylation". Science 327 (5968): 1000–1004. Bibcode:2010Sci...327.1000Z. PMC 3232675. PMID 20167786. doi:10.1126/science.1179689.
- ↑ 7,0 7,1 Van Damme P, Hole K, Pimenta-Marques A, Helsens K, Vandekerckhove J, Martinho RG, Gevaert K, Arnesen T (2011). "NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation". PLoS Genet. 7 (7): e1002169. PMC 3131286. PMID 21750686. doi:10.1371/journal.pgen.1002169.
- ↑ Starheim KK, Gevaert K, Arnesen T (2012). "Protein N-terminal acetyltransferases: when the start matters". Trends Biochem. Sci. 37 (4): 152–161. PMID 22405572. doi:10.1016/j.tibs.2012.02.003.
- ↑ Liszczak G, Goldberg JM, Foyn H, Petersson EJ, Arnesen T, Marmorstein R (2013). "Molecular basis for N-terminal acetylation by the heterodimeric NatA complex". Nat. Struct. Mol. Biol. 20 (9): 1098–105. PMC 3766382. PMID 23912279. doi:10.1038/nsmb.2636.
- ↑ Starheim KK, Gromyko D, Velde R, Varhaug JE, Arnesen T (2009). "Composition and biological significance of the human Nalpha-terminal acetyltransferases". BMC Proc. 3 Suppl 6 (Suppl 6): S3. PMC 2722096. PMID 19660096. doi:10.1186/1753-6561-3-s6-s3.
- ↑ Arnesen T, Van Damme P, Polevoda B, Helsens K, Evjenth R, Colaert N, Varhaug JE, Vandekerckhove J, Lillehaug JR, Sherman F, Gevaert K (2009). "Proteomics analyses reveal the evolutionary conservation and divergence of N-terminal acetyltransferases from yeast and humans". Proc. Natl. Acad. Sci. U.S.A. 106 (20): 8157–8162. Bibcode:2009PNAS..106.8157A. PMID 19420222. doi:10.1073/pnas.0901931106.
- ↑ Arnesen T, Starheim KK, Van Damme P, Evjenth R, Dinh H, Betts MJ, Ryningen A, Vandekerckhove J, Gevaert K, Anderson D (2010). "The chaperone-like protein HYPK acts together with NatA in cotranslational N-terminal acetylation and prevention of Huntingtin aggregation". Mol. Cell. Biol. 30 (8): 1898–1909. PMC 2849469. PMID 20154145. doi:10.1128/mcb.01199-09.
- ↑ Hole K, Van Damme P, Dalva M, Aksnes H, Glomnes N, Varhaug JE, Lillehaug JR, Gevaert K, Arnesen T (2011). "The human N-alpha-acetyltransferase 40 (hNaa40p/hNatD) is conserved from yeast and N-terminally acetylates histones H2A and H4". PLoS ONE 6 (9): e24713. Bibcode:2011PLoSO...624713H. PMC 3174195. PMID 21935442. doi:10.1371/journal.pone.0024713.
- ↑ Gautschi M, Just S, Mun A, Ross S, Rücknagel P, Dubaquié Y, Ehrenhofer-Murray A, Rospert S (2003). "The yeast N(alpha)-acetyltransferase NatA is quantitatively anchored to the ribosome and interacts with nascent polypeptides". Mol. Cell. Biol. 23 (20): 7403–7414. PMC 230319. PMID 14517307. doi:10.1128/mcb.23.20.7403-7414.2003.
- ↑ Hollebeke J, Van Damme P, Gevaert K (2012). "N-terminal acetylation and other functions of Nα-acetyltransferases". Biol. Chem. 393 (4): 291–8. PMID 22718636. doi:10.1515/hsz-2011-0228.
- ↑ Hershko A, Heller H, Eytan E, Kaklij G, Rose IA (1984). "Role of the alpha-amino group of protein in ubiquitin-mediated protein breakdown". Proc. Natl. Acad. Sci. U.S.A. 81 (22): 7021–5. Bibcode:1984PNAS...81.7021H. PMC 392068. PMID 6095265. doi:10.1073/pnas.81.22.7021.
- ↑ Hwang CS, Shemorry A, Varshavsky A (2010). "N-terminal acetylation of cellular proteins creates specific degradation signals". Science 327 (5968): 973–977. Bibcode:2010Sci...327..973H. PMID 20110468. doi:10.1126/science.1183147.
- ↑ Behnia R, Panic B, Whyte JR, Munro S (2004). "Targeting of the Arf-like GTPase Arl3p to the Golgi requires N-terminal acetylation and the membrane protein Sys1p". Nat. Cell Biol. 6 (5): 405–413. PMID 15077113. doi:10.1038/ncb1120.
- ↑ Starheim KK, Gromyko D, Evjenth R, Ryningen A, Varhaug JE, Lillehaug JR, Arnesen T (2009). "Knockdown of human N alpha-terminal acetyltransferase complex C leads to p53-dependent apoptosis and aberrant human Arl8b localization". Mol. Cell. Biol. 29 (13): 3569–3581. PMC 2698767. PMID 19398576. doi:10.1128/mcb.01909-08.
- ↑ Gromyko D, Arnesen T, Ryningen A, Varhaug JE, Lillehaug JR (2010). "Depletion of the human Nα-terminal acetyltransferase A induces p53-dependent apoptosis and p53-independent growth inhibition". Int. J. Cancer 127 (12): 2777–2789. PMID 21351257. doi:10.1002/ijc.25275.
- ↑ Yi CH, Pan H, Seebacher J, Jang IH, Hyberts SG, Heffron GJ, Vander Heiden MG, Yang R, Li F, Locasale JW, Sharfi H, Zhai B, Rodriguez-Mias R, Luithardt H, Cantley LC, Daley GQ, Asara JM, Gygi SP, Wagner G, Liu CF, Yuan J (2011). "Metabolic regulation of protein N-alpha-acetylation by Bcl-xL promotes cell survival". Cell 146 (4): 607–620. PMC 3182480. PMID 21854985. doi:10.1016/j.cell.2011.06.050.
- ↑ Kamita M, Kimura Y, Ino Y, Kamp RM, Polevoda B, Sherman F, Hirano H (2011). "N(α)-Acetylation of yeast ribosomal proteins and its effect on protein synthesis". J Proteomics 74 (4): 431–441. PMID 21184851. doi:10.1016/j.jprot.2010.12.007.
- ↑ Yu M, Gong J, Ma M, Yang H, Lai J, Wu H, Li L, Li L, Tan D (2009). "Immunohistochemical analysis of human arrest-defective-1 expressed in cancers in vivo". Oncol. Rep. 21 (4): 909–15. PMID 19287988. doi:10.3892/or_00000303.
- ↑ Kalvik TV, Arnesen T (2013). "Protein N-terminal acetyltransferases in cancer". Oncogene 32 (3): 269–276. PMID 22391571. doi:10.1038/onc.2012.82.
- ↑ Sadoul K, Boyault C, Pabion M, Khochbin S (2008). "Regulation of protein turnover by acetyltransferases and deacetylases". Biochimie 90 (2): 306–12. PMID 17681659. doi:10.1016/j.biochi.2007.06.009.
- ↑ Glozak MA, Sengupta N, Zhang X, Seto E (2005). "Acetylation and deacetylation of non-histone proteins". Gene 363: 15–23. PMID 16289629. doi:10.1016/j.gene.2005.09.010.
- ↑ Yang XJ, Seto E (2008). "Lysine acetylation: codified crosstalk with other posttranslational modifications". Mol. Cell 31 (4): 449–61. PMC 2551738. PMID 18722172. doi:10.1016/j.molcel.2008.07.002.
- ↑ Eddé B, Denoulet P, de Néchaud B, Koulakoff A, Berwald-Netter Y, Gros F (1989). "Posttranslational modifications of tubulin in cultured mouse brain neurons and astroglia". Biol. Cell 65 (2): 109–117. PMID 2736326. doi:10.1016/0248-4900(89)90018-x.
- ↑ Maruta H, Greer K, Rosenbaum JL (1986). "The acetylation of alpha-tubulin and its relationship to the assembly and disassembly of microtubules". J. Cell Biol. 103 (2): 571–579. PMC 2113826. PMID 3733880. doi:10.1083/jcb.103.2.571.
- ↑ Alberts, Bruce (March 2002). Molecular Biology of the Cell. Garland Science. ISBN 0815332181.
- ↑ Weinberg, Robert A. (2013). Biology of cancer. (2. ed.). [S.l.]: Garland Science. ISBN 0815342209.
- ↑ Brooks CL, Gu W (2011). "The impact of acetylation and deacetylation on the p53 pathway". Protein Cell 2 (6): 456–462. PMID 21748595. doi:10.1007/s13238-011-1063-9.
- ↑ Tang Y, Zhao W, Chen Y, Zhao Y, Gu W (2008). "Acetylation is indispensable for p53 activation". Cell 133 (4): 612–626. PMC 2914560. PMID 18485870. doi:10.1016/j.cell.2008.03.025.
- ↑ Yamaguchi H, Woods NT, Piluso LG, Lee HH, Chen J, Bhalla KN, Monteiro A, Liu X, Hung MC, Wang HG (2009). "p53 acetylation is crucial for its transcription-independent proapoptotic functions". J. Biol. Chem. 284 (17): 11171–11183. PMC 2670122. PMID 19265193. doi:10.1074/jbc.M809268200.
- ↑ Vassilev LT, Vu BT, Graves B, Carvajal D, Podlaski F, Filipovic Z, Kong N, Kammlott U, Lukacs C, Klein C, Fotouhi N, Liu EA (2004). "In vivo activation of the p53 pathway by small-molecule antagonists of MDM2". Science 303 (5659): 844–848. Bibcode:2004Sci...303..844V. PMID 14704432. doi:10.1126/science.1092472.
- ↑ Shangary S, Wang S (2009). "Small-molecule inhibitors of the MDM2-p53 protein-protein interaction to reactivate p53 function: a novel approach for cancer therapy". Annu. Rev. Pharmacol. Toxicol. 49 (1): 223–241. PMC 2676449. PMID 18834305. doi:10.1146/annurev.pharmtox.48.113006.094723.
- ↑ Zajkowicz A, Krześniak M, Matuszczyk I, Głowala-Kosińska M, Butkiewicz D, Rusin M (2013). "Nutlin-3a, an MDM2 antagonist and p53 activator, helps to preserve the replicative potential of cancer cells treated with a genotoxic dose of resveratrol". Mol. Biol. Rep. 40 (8): 5013–5026. PMC 3723979. PMID 23666059. doi:10.1007/s11033-013-2602-7.
- ↑ Kumamoto K, Spillare EA, Fujita K, Horikawa I, Yamashita T, Appella E, Nagashima M, Takenoshita S, Yokota J, Harris CC (2008). "Nutlin-3a activates p53 to both down-regulate inhibitor of growth 2 and up-regulate mir-34a, mir-34b, and mir-34c expression, and induce senescence". Cancer Res. 68 (9): 3193–3203. PMC 2440635. PMID 18451145. doi:10.1158/0008-5472.CAN-07-2780.
- ↑ Kreis, ed. by Thomas; Vale, Ronald (1999). Guidebook to the cytoskeletal and motor proteins (2. ed.). Oxford [u.a.]: Oxford Univ. Press. ISBN 0198599560.
- ↑ al.], Harvey Lodish ... [et (2013). Molecular cell biology (7th ed.). New York: W.H. Freeman and Co. ISBN 142923413X.
- ↑ Fojo, edited by Tito (2008). The role of microtubules in cell biology, neurobiology, and oncology ([Online-Ausg.] ed.). Totowa, N. J.: Humana Press. ISBN 1588292940.
- ↑ 42,0 42,1 Friedmann DR, Aguilar A, Fan J, Nachury MV, Marmorstein R (2012). "Structure of the α-tubulin acetyltransferase, αTAT1, and implications for tubulin-specific acetylation". Proc. Natl. Acad. Sci. U.S.A. 109 (48): 19655–19660. Bibcode:2012PNAS..10919655F. PMID 23071314. doi:10.1073/pnas.1209357109.
- ↑ Hubbert C, Guardiola A, Shao R, Kawaguchi Y, Ito A, Nixon A, Yoshida M, Wang XF, Yao TP (2002). "HDAC6 is a microtubule-associated deacetylase". Nature 417 (6887): 455–458. Bibcode:2002Natur.417..455H. PMID 12024216. doi:10.1038/417455a.
- ↑ Teresa Carlomagno, ed. (2009). Tubulin-binding agents : synthetic, structural, and mechanistic insights. contributions by K.-H. Altmann. Berlin: Springer. ISBN 3540690360.
- ↑ Zito, edited by Thomas L. Lemke, David A. Williams; associate editors, Victoria F. Roche, S. William (2013). Foye's principles of medicinal chemistry (7th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 1609133455.
- ↑ Müller-Decker, Friedrich Marks, Ursula Klingmüller, Karin (2009). Cellular signal processing : an introduction to the molecular mechanisms of signal transduction. New York: Garland Science. ISBN 0815342152.
- ↑ Yuan ZL, Guan YJ, Chatterjee D, Chin YE (2005). "Stat3 dimerization regulated by reversible acetylation of a single lysine residue". Science 307 (5707): 269–273. Bibcode:2005Sci...307..269Y. PMID 15653507. doi:10.1126/science.1105166.
- ↑ Lee H, Zhang P, Herrmann A, Yang C, Xin H, Wang Z, Hoon DS, Forman SJ, Jove R, Riggs AD, Yu H (2012). "Acetylated STAT3 is crucial for methylation of tumor-suppressor gene promoters and inhibition by resveratrol results in demethylation". Proc. Natl. Acad. Sci. U.S.A. 109 (20): 7765–7769. Bibcode:2012PNAS..109.7765L. PMID 22547799. doi:10.1073/pnas.1205132109.
